
徐楠杰
神经细胞发育与脑功能失调研究组
电话:021-34696293;
邮箱:xunanjie@shsmu.edu.cn
地址:上海市黄浦区重庆南路280号 欧洲杯竞猜平台 西5号楼303室
徐楠杰研究员,博士生导师,解剖学与生理学系副主任, “神经细胞发育与脑功能失调”研究组组长。入选国家海外高层次人才计划,上海市浦江人才计划。担任中国细胞生物学会神经细胞生物学分会会长,中国细胞生物学学会科普工作委员会副主委、青年工作委员会委员,中国神经科学学会神经发育与再生分会委员,上海市神经科学学会理事。主要工作发表于Nature Neuroscience,Nature Communications,Science Advances,Molecular Psychiatry, Journal of Cell Biology,Journal of Neuroscience等本领域一流国际期刊。
研究方向
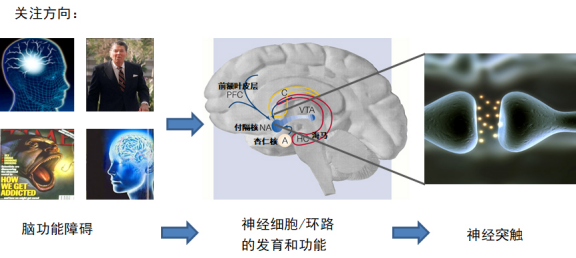
研究兴趣集中在神经干细胞发育,神经连接和突触形成过程中的受体信号和神经系统疾病的发生机制。
成体神经干细胞发育和神经功能 神经干细胞/祖细胞和神经前体细胞存在于发育过程中和成年的脑中,对于神经环路的维持和更新起着关键作用。酪氨酸激酶受体参与调节神经干细胞的多个发育过程,如增殖,迁移,分化和谱系可塑性等。我们的研究目标是解析成体神经干细胞中受体信号并阐明环境刺激对神经干细胞的命运的调节作用。 神经环路的形成和功能 长距离神经环路连接过程中如何整合外界信号到脑内的认知和情感关键核团如海马,伏隔核, 杏仁核和腹侧背盖区,以及这些核团之间如何相互交流,进而调节情绪,奖赏,学习和记忆等高级神经活动仍然是尚待解决的问题。我们感兴趣并要阐明的两个问题是:1)神经酪氨酸激酶受体配体结合介导的神经细胞联系在关键神经核团之间形成的神经环路中的作用;2)神经受体介导的神经环路的形成如何支持重要脑功能的产生。 神经精神疾病的分子细胞机制 Eph/ephrin和谷氨酸受体如NR1,mGluR5等受体的相互作用成为许多神经精神疾病的关键环节。我们在神经发育性和神经退行性疾病的模型中,如孤独症和阿尔茨海默病等病理条件下探讨Eph/ephrin受体及其介导的信号对谷氨酸受体的调节作用,寻求脑疾病发生的神经和分子机制。
科研项目
国家自然科学基金重点项目:出生后发育期社交行为的突触发生和环路形成机制(2021-2025) 国家自然科学基金面上项目:阿尔茨海默病早期异常情感表征和认知环路调节机制(2019 -2022) 国家自然科学基金面上项目:PDZ蛋白Lnx1介导的海马神经环路发育和可塑性机制 (2017-2020) 国家自然科学基金面上项目:EphB受体信号介导的神经干细胞分化机制 (2014-2017) 国家重点基础研究发展计划(973项目子课题):调控前脑神经祖细胞发育过程的微环境解析(2014-2018) 国家自然科学基金重大研究计划培育项目:Eph-ephrin受体信号介导的情感和记忆相关神经环路的发育机制 (2013-2015) 国家自然科学基金面上项目:神经轴突剪切的Eph-ephrin双向信号转导(2012-2012)
代表性论文、专著与专利
Wu XR (吴欣蓉)#, Zhang Y (张豫)#, Liu XD, Han WB, Xu NJ*, Sun S*. EphB2 mediates social isolation-induced memory forgetting. Transl Psychiatry, 10:389 (2020). Ai PH (艾鹏辉)#, Chen S (陈偲)#, Liu XD, Zhu XN, Pan YB, Feng DF, Chen SD, Xu NJ*, Sun S*. Paroxetine ameliorates prodromal emotional dysfunction and late-onset memory deficit in Alzheimer’s disease mice. Transl Neurodegener, 9:18 (2020). Liu XD (刘贤东)#, Ai PH (艾鹏辉)#, Zhu XN, Pan YB, Halford MM, Henkemeyer M, Feng DF, Xu TL, Sun S*, Xu NJ*. Hippocampal Lnx1-NMDAR multi-protein complex mediates initial social memory. Mol Psychiatry, doi:10.1038/s41380-019-0606-y (2019). Dong J (董健), Pan YB, Wu XR, He LN, Liu XD, Feng DF, Xu TL, Sun S*, Xu NJ*. A neuronal molecular switch through cell-cell contact that regulates quiescent neural stem cells. Sci Adv, 5: eaav4416 (2019). Liu XD (刘贤东), Zhu XN, Halford MM, Xu TL, Henkemeyer M, Xu NJ*. Retrograde regulation of mossy fiber axon targeting and terminal maturation via postsynaptic Lnx1. J Cell Biol, 217: 4007-4024 (2018). Huang GH (黄国辉)#, Guo L (郭霖)#, Zhu L, Liu XD, Sun ZL, Li HJ, Xu NJ*, Feng DF*. Neuronal GAP-Porf-2 transduces EphB1 signaling to brake axon growth. Cell Mol Life Sci, 75: 4207-4222 (2018). Zhu XN (朱晓娜), Liu XD, Zhuang H, Henkemeyer M, Yang JY*, Xu NJ*. Amygdala EphB2 signaling regulates glutamatergic neuron maturation and innate fear. J Neurosci, 36(39):10151-10162 (2016). Zhu XN (朱晓娜), Liu XD, Sun S*, Zhuang H, Yang JY, Henkemeyer M, Xu NJ*. Ephrin-B3 mediates timed axon targeting and amygdala spinogenesis for innate fear behaviour. Nat Commun, 7:11096 (2016). Sun S, Zhang H, Liu J, Popugaeva E, Xu NJ, Feske S, Bezprozvanny I*. Reduced synaptic STIM2 expression and impaired store-operated calcium entry cause destabilization of mature spines in mutant presenilin mice. Neuron, 81: 79-93 (2014). Xu NJ*, Henkemeyer M*. Ephrin reverse signaling in axon guidance and synaptogenesis. Semin Cell Dev Biol, 23: 58-64 (2012). (Invited Review) Xu NJ, Sun S, Gibson J and Henkemeyer M*. A dual shaping mechanism for postsynaptic ephrin-B3 as a receptor that sculpts dendrites and synapses. Nat Neurosci, 14: 1421-1429 (2011). Genander M, Halford MM, Xu NJ, Eriksson M, Yu Z, Qiu Z, Martling A, Greicius G, Chumley MJ, Zdunek S, Wang C, Holm T, Goff SP, Pettersson S, Pestell RG, Henkemeyer M and Frisén J*. Dissociation of EphB2 signaling pathways mediating progenitor cell proliferation and tumor suppression. Cell, 139: 679-692 (2009). Xu NJ, Henkemeyer M*. Ephrin-B3 reverse signaling through Grb4 and downstream cytoskeletal regulators mediates axon pruning. Nat Neurosci, 12: 268-276 (2009). Aoto J, Ting P, Maghsoodi B, Xu NJ, Henkemeyer M, Chen L*. Postsynaptic ephrinB3 promotes shaft glutamatergic synapse formation. J Neurosci, 27: 5708-19 (2007). Armstrong JN, Saganich MJ, Xu NJ, Henkemeyer M, Heinemann SF, Contractor A*. B-ephrin reverse signaling is required for NMDA-independent long-term potentiation of mossy fibers in the hippocampus. J Neurosci, 26: 3474-81 (2006). Xu NJ#, Yu YX#, Zhu JM, Liu H, Shen L, Zen R, Zhang X, Pei G*. Inhibition of SNAP-25 phosphorylation at Ser187 is involved in chronic morphine-induced down-regulation of SNARE complex formation. J Biol Chem, 279: 40601-8 (2004). Xu NJ, Bao L, Fan HP, Bao GB, Pu L, Lu YJ, Wu CF, Zhang X, Pei G*. Morphine withdrawal increases neuronal glutamate uptake and surface expression of glutamate transporter GLT1 at hippocampal synapses. J Neurosci, 23: 4775-4784 (2003). Pu L, Bao GB, Xu NJ, Ma L, Pei G*. Hippocampal long-term potentiation is reduced by chronic opiate treatment and can be restored by re-exposure to opiates. J Neurosci, 22: 1914-21 (2002). Lu L, Xu NJ, Ge X, Yue W, Su WJ, Pei G, Ma L*. Reactivation of morphine conditioned place preference by drug priming: role of environmental cues and sensitization. Psychopharmacology, 159: 125-132 (2002).
团队介绍
实验室毕业博士研究生(含联合培养):
朱晓娜博士 2012.8-2016.6 (联培),博士后 2016.9-2018.12 刘贤东博士 2013.4-2018.12, 博士后2019.1- 董健博士 2013.5-2019.6 黄国辉博士 2013.6-2017.6 (联培) 郭霖博士 2014.5-2018.12
|



