2月27日,欧洲杯竞猜平台基础欧洲杯竞猜平台、上海市免疫学研究所邹强研究团队等在Immunity杂志在线发表了题为“Lactate modulates RNA splicing to promote CTLA-4 expression in tumor-infiltrating regulatory T cells”的研究论文。该研究发现代谢产物乳酸通过促进肿瘤浸润Treg细胞中CTLA-4的RNA剪接及其表达从而维持Treg细胞免疫抑制功能的作用机制,阐述了乳酸-Foxp3-USP39-CTLA-4信号轴介导肿瘤浸润Treg细胞高表达CTLA-4的分子机制,提示肿瘤免疫治疗的新方向即靶向Treg细胞RNA剪接以增强抗肿瘤免疫治疗的应用前景。

免疫检查点阻断疗法(ICB)在肿瘤治疗中取得巨大进展。其中,CTLA-4作为经典的免疫检查点,通过多种机制负调控T细胞活性1。靶向CTLA-4的单克隆抗体作为第一个获批上市的免疫检查点抑制剂药物,在临床肿瘤治疗中得到广泛应用。CTLA-4单抗不仅激活效应T细胞,也能通过结合FcgR清除肿瘤浸润Treg细胞2,3。然而,临床上也存在部分肿瘤患者无法响应CTLA-4单抗治疗,且CTLA-4单抗治疗带来的免疫相关副反应(irAEs)给肿瘤患者带来巨大痛苦。已有的研究表明,肿瘤细胞利用无氧糖酵解产生的乳酸在肿瘤微环境中发挥重要的免疫调节作用。乳酸能够增强肿瘤浸润Treg细胞的免疫抑制活性,包括通过调控Treg细胞中PD-1的表达影响PD-1单抗治疗肿瘤疗效4,5。CTLA-4作为Treg细胞中另一个重要的免疫检查点,乳酸是否调控CTLA-4表达水平进而影响CTLA-4单抗疗效的机制亟待揭示。
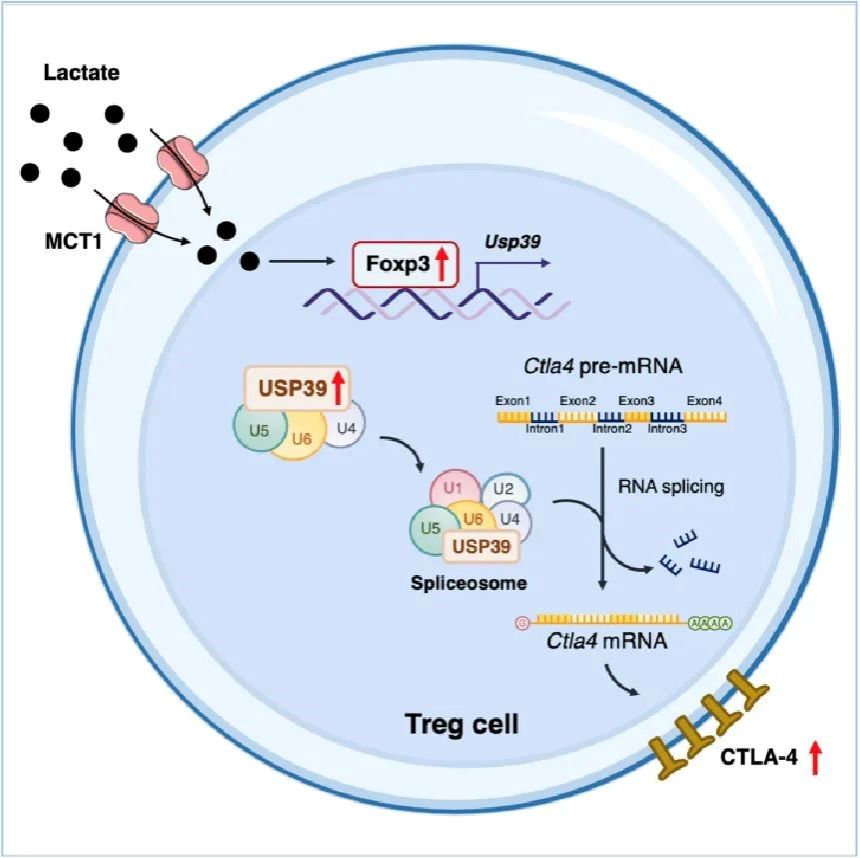
研究团队结合大数据分析和多种小鼠肿瘤模型发现,Treg细胞中乳酸转运受体MCT1特异性缺失的荷瘤小鼠无法响应CTLA-4单抗治疗。进一步实验结果表明,肿瘤浸润Treg细胞通过乳酸转运受体MCT1摄取乳酸,促进Foxp3的表达;Foxp3作为Treg细胞中关键的转录因子,促进剪接体关键组分USP39的转录及表达。USP39对于mRNA前体(pre-mRNA)剪接和成熟至关重要,研究人员通过转录组测序分析发现USP39特异性调控Ctla4 pre-mRNA的剪接,进而促进Treg细胞中CTLA-4的表达,从而影响CTLA-4单抗疗效。同时,研究团队分析结直肠癌患者外周Treg细胞和肿瘤浸润Treg细胞发现,USP39的表达和CTLA4 pre-mRNA剪接效率在Treg细胞浸润至肿瘤微环境后被显著上调。综上,该项研究阐明了肿瘤浸润Treg细胞中“乳酸-Foxp3-USP39-CTLA-4”信号轴介导CTLA-4高表达的分子机制,揭示了代谢产物乳酸影响ICB疗效的作用机制,提示了靶向Treg细胞RNA剪接以增强抗肿瘤免疫治疗的的治疗潜力和临床应用前景。
欧洲杯竞猜平台基础欧洲杯竞猜平台、上海市免疫学研究所博士生丁睿、副研究员于晓彦和南京医科大学基础欧洲杯竞猜平台胡志林教授为文章的共同第一作者。欧洲杯竞猜平台基础欧洲杯竞猜平台、上海市免疫学研究所邹强研究员、叶幼琼研究员、欧洲杯竞猜平台附属瑞金医院赵任教授和河北工程大学倪志宇教授为文章的通讯作者。本研究得到了国家自然科学基金杰青、重点项目等资助,以及上海市免疫学研究所流式平台、动科部等平台的技术支持。
参考文献
1.Van Coillie, S.; Wiernicki, B.; Xu, J., Molecular and Cellular Functions of CTLA-4. Adv Exp Med Biol 2020, 1248, 7-32.
2.Leach, D. R.; Krummel, M. F.; Allison, J. P., Enhancement of antitumor immunity by CTLA-4 blockade. Science 1996, 271 (5256), 1734-6.
3.Simpson, T. R.; Li, F.; Montalvo-Ortiz, W.; Sepulveda, M. A.; Bergerhoff, K.; Arce, F.; Roddie, C.; Henry, J. Y.; Yagita, H.; Wolchok, J. D.; Peggs, K. S.; Ravetch, J. V.; Allison, J. P.; Quezada, S. A., Fc-dependent depletion of tumor-infiltrating regulatory T cells co-defines the efficacy of anti-CTLA-4 therapy against melanoma. J Exp Med 2013, 210 (9), 1695-710.
4.Watson, M. J.; Vignali, P. D. A.; Mullett, S. J.; Overacre-Delgoffe, A. E.; Peralta, R. M.; Grebinoski, S.; Menk, A. V.; Rittenhouse, N. L.; DePeaux, K.; Whetstone, R. D.; Vignali, D. A. A.; Hand, T. W.; Poholek, A. C.; Morrison, B. M.; Rothstein, J. D.; Wendell, S. G.; Delgoffe, G. M., Metabolic support of tumour-infiltrating regulatory T cells by lactic acid. Nature 2021, 591 (7851), 645-651.
5.Kumagai, S.; Koyama, S.; Itahashi, K.; Tanegashima, T.; Lin, Y. T.; Togashi, Y.; Kamada, T.; Irie, T.; Okumura, G.; Kono, H.; Ito, D.; Fujii, R.; Watanabe, S.; Sai, A.; Fukuoka, S.; Sugiyama, E.; Watanabe, G.; Owari, T.; Nishinakamura, H.; Sugiyama, D.; Maeda, Y.; Kawazoe, A.; Yukami, H.; Chida, K.; Ohara, Y.; Yoshida, T.; Shinno, Y.; Takeyasu, Y.; Shirasawa, M.; Nakama, K.; Aokage, K.; Suzuki, J.; Ishii, G.; Kuwata, T.; Sakamoto, N.; Kawazu, M.; Ueno, T.; Mori, T.; Yamazaki, N.; Tsuboi, M.; Yatabe, Y.; Kinoshita, T.; Doi, T.; Shitara, K.; Mano, H.; Nishikawa, H., Lactic acid promotes PD-1 expression in regulatory T cells in highly glycolytic tumor microenvironments. Cancer Cell 2022, 40 (2), 201-218.e9.



