近日,药理学与化学生物学系高小玲教授在国际权威杂志《先进材料》(Advanced Materials)正式发表了题为“Brain delivery of protein therapeutics by cell matrix-inspired biomimetic nanocarrier”的研究论文。该研究基于仿生学原理,模拟蛋白质天然存在环境和天然纳米载体体内转运机制,采用仿生的类细胞基质核心和重组高密度脂蛋白(reconstituted High. Density Lipoprotein,rHDL)分别模拟细胞基质和高密度脂蛋白(High Density Lipoprotein,HDL)结构,构建仿生蛋白质治疗药物载体实现脑内递送和生物学效应的发挥。

蛋白质药物已成为医药领域最受关注的焦点,连续多年占据全球前十畅销药榜首。然而,蛋白质的三维结构脆弱,半衰期短,分子量大和亲水特性等使其难以高效跨越血脑屏障(Blood-Brain Barrier,BBB)和细胞膜,极大限制了蛋白质药物在中枢神经系统疾病治疗中的潜在应用前景。探索有效安全可控的蛋白质治疗药物脑内递送载体具有十分重要科学意义和应用转化价值。
该研究采用细胞基质组分透明质酸和鱼精蛋白,与蛋白质通过电荷作用自组装形成载蛋白质的仿生核心,透明质酸和鱼精蛋白两者相反的带电性质可平衡蛋白质药物等电点差异,使载体的载药性能不受蛋白质理化性质限制,具备载带蛋白质药物的普适性。同时,类细胞基质的仿生核心模仿天然蛋白质储存环境有效保护蛋白质的生物活性。进一步采用rHDL包裹载蛋白质药物的仿生核心形成“类细胞基质”的仿生纳米载体,模拟生物体内转运蛋白质的囊泡结构,实现蛋白质药物的体内长循环,并借助rHDL的靶向递送特性,实现多种不同理化性质蛋白质的脑内靶细胞递送。
为揭示“类细胞基质”的仿生纳米载体介导蛋白质药物的细胞转运的机制,研究人员采用溶酶体逃逸实验发现仿生纳米载体可避开溶酶体直接将过氧化氢酶(Catalase, CAT)转运至小胶质细胞质;内吞通路抑制剂实验发现巨胞饮通路参与仿生纳米载体的细胞摄取;CAT和仿生纳米载体在细胞质和细胞膜的定位分析、膜融合探针标记实验和全内反射荧光显微镜成像结果均显示仿生纳米载体的细胞摄取过程存在膜融合机制;透射电子显微镜观察发现部分仿生纳米载体与早期巨胞饮体发生膜融合,介导CAT的胞内高效释放。上述结果表明,该仿生纳米载体通过与细胞膜和巨胞饮体的膜融合机制高效将蛋白质转运至细胞内发挥生物学活性。
进一步通过中枢神经系统疾病相关病理动物模型评价其药理学效应。研究表明该载CAT功能蛋白的仿生纳米制剂能显著改善控制性皮质损伤(Controlled Cortical Impact,CCI)模型小鼠脑内细胞病理形态、减少神经元丢失、降低胶质细胞增生,促进CCI模型小鼠空间学习记忆能力恢复;同时该制剂也能显著减少肌萎缩侧索硬化症(Amyotrpnic Lateral Sclerosis,ALS)模型小鼠脊髓神经元丢失、改善脊髓组织病理形态、降低胶质细胞增生,改善ALS模型小鼠运动功能并延长其生存期。
欧洲杯竞猜平台黄佳琳博士、傅玉立同学为该论文的共同第一作者,高小玲教授为通讯作者,上海中医药大学曙光医院未来健康实验室陈红专教授为共同通讯作者。该工作得到了国家自然科学基金、国家重点研发计划、上海市科委、上海市教委项目的资助。
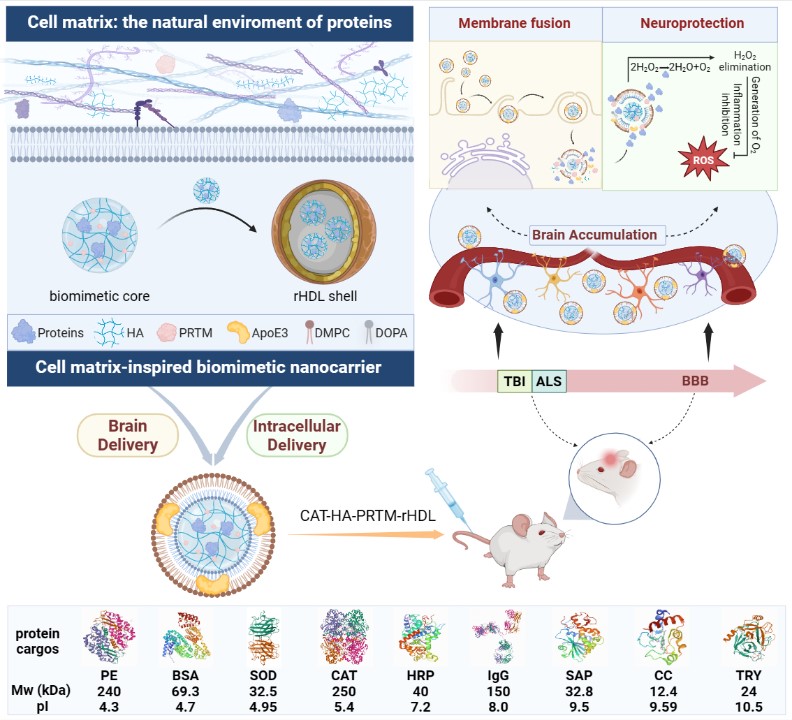
“类细胞基质”的仿生纳米载体实现功能蛋白质脑内递送及其发挥生物学效应机制。
论文链接:Brain Delivery of Protein Therapeutics by Cell Matrix‐inspired Biomimetic Nanocarrier - Huang - Advanced Materials - Wiley Online Library



