6月21日,欧洲杯竞猜平台基础欧洲杯竞猜平台/松江研究院徐天乐教授课题组在Nature Communications在线发表题为“Sensory ASIC3 channel exacerbates psoriatic inflammation via a neurogenic pathway in female mice”的研究论文。该研究综合运用遗传学操纵、脂质代谢组学、电化学分析等技术,揭示了感觉神经元上的酸敏感离子通道3(ASIC3)加剧银屑病神经炎症和皮损的新机制,为银屑病等难治性皮肤病治疗提供了新视角。

银屑病,俗称“牛皮癣”,是一种慢性、复发性的免疫介导性皮肤病,对患者的身心健康造成了严重影响。在银屑病的发病机制中,树突状细胞、Th17细胞和角质形成细胞发挥着关键作用。树突状细胞激活后,能够产生TNF-α和IL-23这两种细胞因子,它们进一步促进T细胞向Th17细胞的分化。分化后的Th17细胞释放IL-17、IFN-γ和IL-22等炎症性细胞因子,这些因子不仅加剧了皮肤炎症反应,还导致角质形成细胞的过度增殖,形成了银屑病的特征性皮损。
除了免疫细胞间的相互作用外,外周感觉神经在维持皮肤屏障稳定中也扮演着不可或缺的角色,它们不仅负责感知外界环境变化,还参与皮肤免疫、炎症反应以及皮肤屏障修复等生理病理过程。尽管我们对银屑病的免疫机制有了一定的了解,神经源性炎症在银屑病发病中的分子机制尚待阐明。
在这项研究中,研究人员从揭示银屑病炎症微环境特征入手,采用了电化学技术结合脂质代谢组学的方法,对银屑病小鼠的皮损区域进行分析,发现银屑病小鼠皮损区除了发生组织酸化,还伴有脂质代谢异常,多种溶血磷脂酰胆碱(LPC)上调。有趣的是,组织酸化和LPC可激活外周感觉神经元上作为细胞外pH感受器的膜离子通道,尤其是ASIC3,其被激活后可以通透钠离子,调控神经元的兴奋性和感觉功能(如痛觉、痒觉等)。LPC也是继徐天乐教授团队发现ASIC3“双门控”机制(分别被H+和非H+配体GMQ激活)之后,又一个非H+配体(图1)。因此,研究团队提出ASIC3通过感知炎症微环境中的H+和LPC影响银屑病进展的设想。
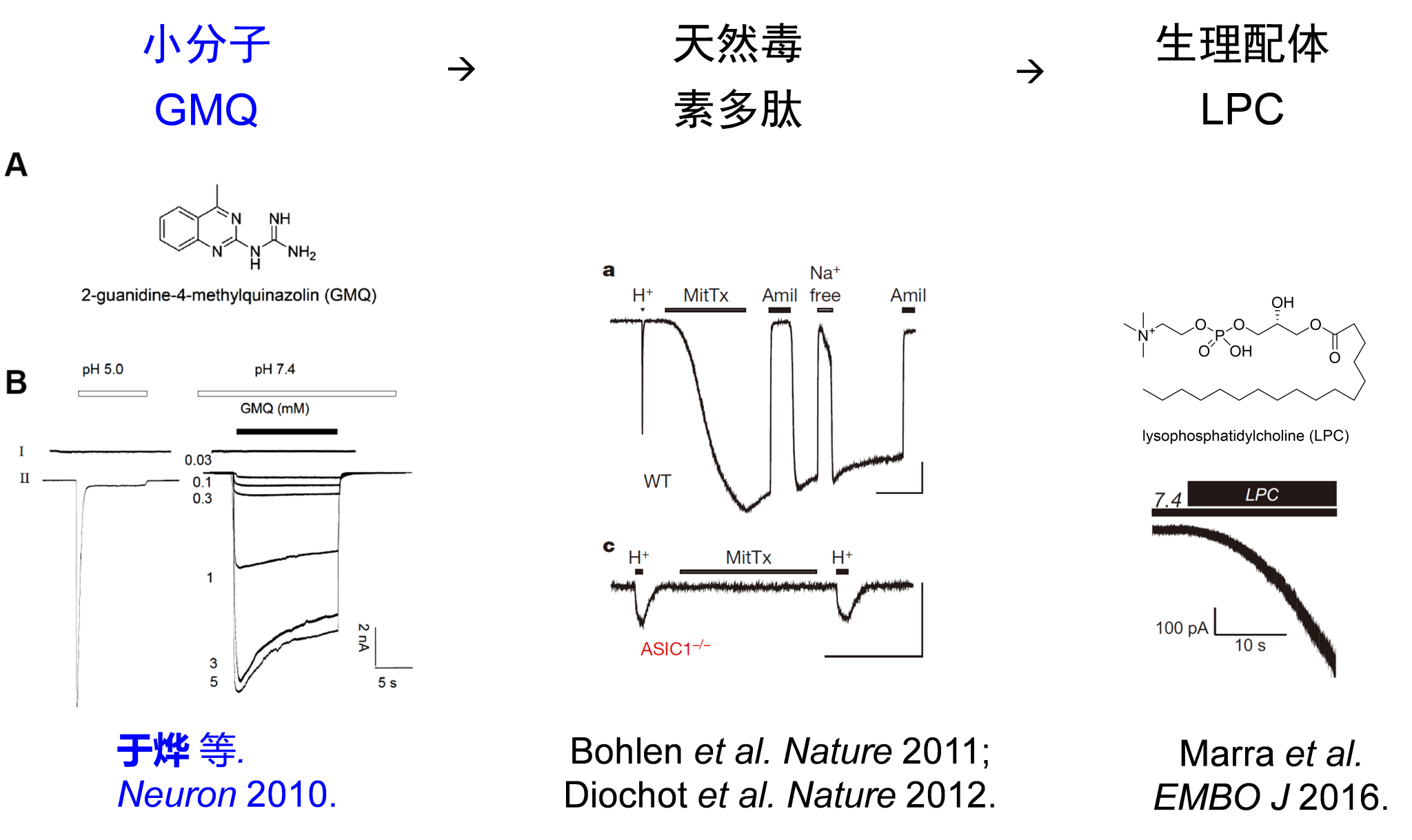
图1. ASIC3非H+配体。
利用ASIC3基因全敲除小鼠(Asic3−/−)、外周伤害性感觉神经元上的条件性敲除小鼠(NaV1.8Cre::Asic3flox/flox),研究团队首先确证了ASIC3尤其是外周伤害性感觉神经元上分布的ASIC3显著贡献于银屑病皮损。进一步的遗传学操纵及药理学干预确证了外周伤害性感受神经元上ASIC3与银屑病皮损病理之间的关联性。同时,银屑病模型小鼠存在感觉神经末梢的异常出芽,皮损部位降钙素基因相关肽(CGRP)阳性神经末梢显著增多;此外,体外实验通过培养原代小鼠脊髓背根神经节(DRG)细胞发现ASIC3的激活可增加CGRP释放。
通过共培养实验,研究发现激活ASIC3释放CGRP后不仅可作用于树突状细胞上的受体诱导IL-23产生,还能诱导皮肤角质形成细胞增殖,贡献银屑病皮损。有趣的是,IL-23可以在ASIC3缺如的情况下直接诱导小鼠银屑病样皮损,提示感觉神经末梢ASIC3àCGRPà树突状细胞àIL23信号通路是银屑病神经免疫调控的新机制。这些发现不仅为理解ASIC3在银屑病炎症中的作用机制提供了新的视角,也为开发针对神经源性炎症的治疗策略提供了潜在的靶点(图2)。
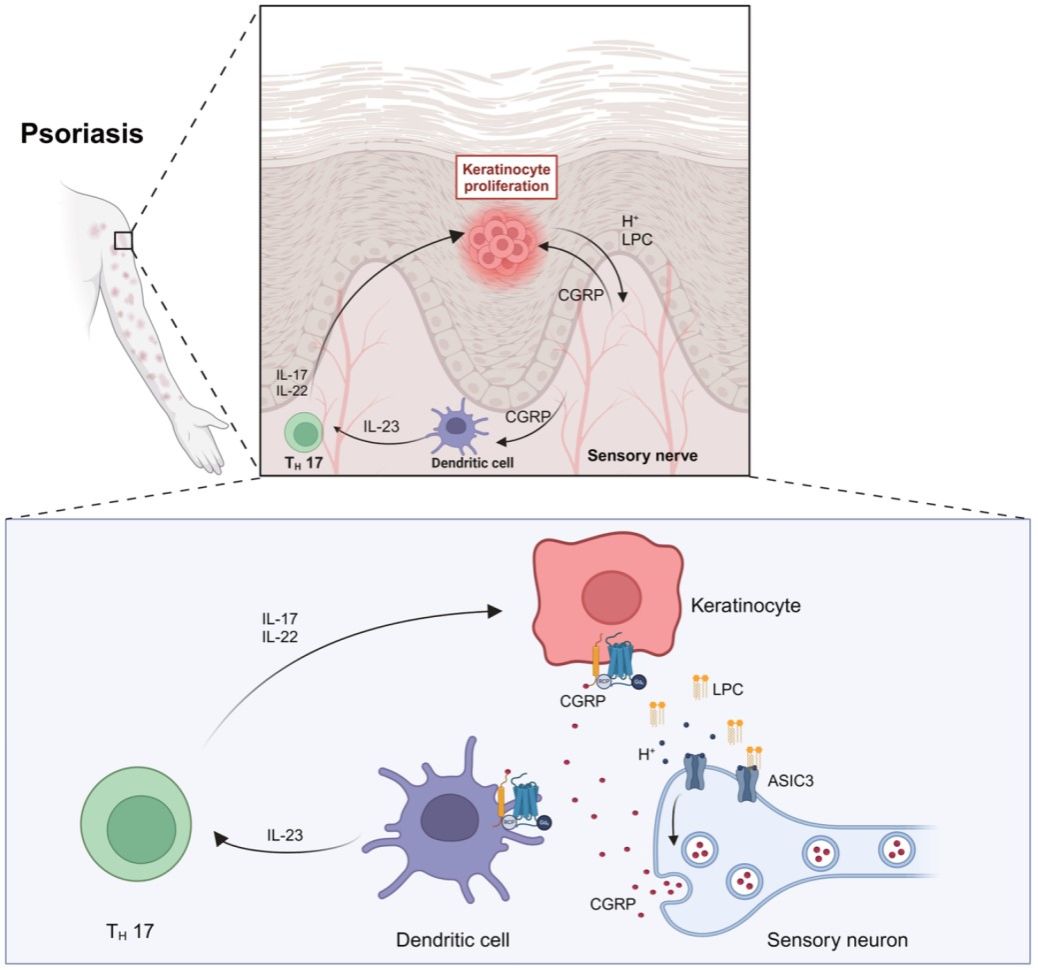
图2. 感觉神经元上ASIC3通过神经免疫互作加剧银屑病皮损的工作模型。
该研究成果由欧洲杯竞猜平台基础欧洲杯竞猜平台黄晨高级实验师、欧洲杯竞猜平台附属新华医院皮肤科孙沛昳博士和欧洲杯竞猜平台附属仁济医院耳鼻喉科江一鸣副主任医师作为第一作者共同完成;齐昕博士、李伟广研究员和徐天乐教授为共同通讯作者。这项研究得到了科技创新2030—“脑科学与类脑研究”重大项目、国家自然科学基金、美国国立卫生研究院研究基金、上海市科学技术委员会基金、上海市卫生健康委员会基金、上海市高水平地方大学创新研究团队等支持。同时,还得到上海市第一人民医院王宏林教授、新华医院姚志荣教授、美国德克萨斯大学朱曦教授、华东师范大学田阳教授等合作支持。
徐天乐教授长期致力于氢离子(H+)门控的酸敏感离子通道(ASIC)的生理功能和门控机理研究。经二十余年对H+-ASIC的系统研究,取得三个重要发现。一是发现ASIC除了传统H+配体外,还存在着非H+配体,进而证明ASIC为双配体门控离子通道;二是揭示H+-ASIC广泛参与突触可塑性、学习记忆等生理过程以及慢性痛、脑卒中等病理过程,明确了H+的信号功能;三是发现了H+-ASIC1a-RIPK1细胞死亡新通路。这些发现拓展了ASIC的内涵,并引领了ASIC研究的范式变革。系列研究成果在Neuron、J Neurosci、eLife等发表后,被引用近万次。近年来拓展的另一研究方向从神经环路的视角探索精神性疾病的干预新途径。



