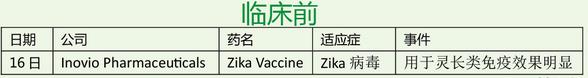
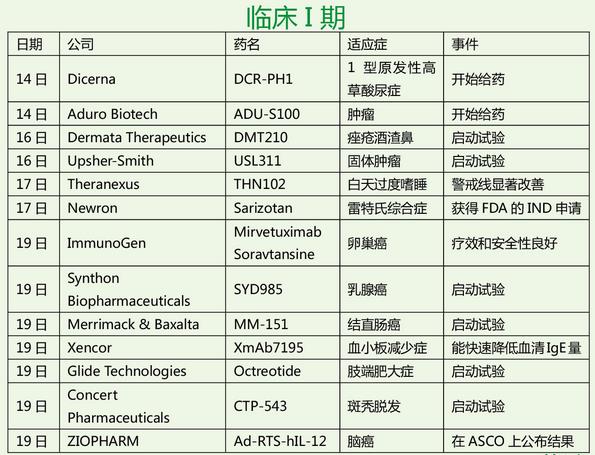
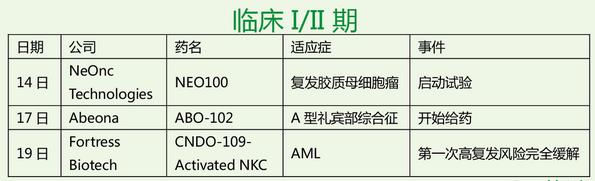
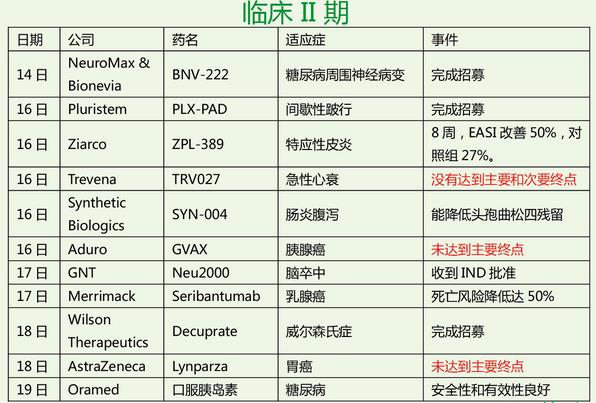
本周,罗氏为风云人物,Atezolizumab两个“首个”入囊,美中不足,英国NICE 拒绝乳腺癌药Perjeta;Opdivo荣登明星药,第四个适应症获批,而且两个两年的临床III期和多西紫杉醇研究比较,OS分别延长了一倍和两倍;失落榜这回挤进三个,Trevena的TRV027治疗急性心衰临床II期失败,Aduro肿瘤疫苗组合治疗胰腺癌临床II期失败,阿斯利康Lynparza (olaparib) 联合紫杉醇化疗治疗晚期胃癌临床II期失败。对了,本周还有一个在偷笑,诺华,Ribociclib因疗效好,IDMC建议提前结束临床III期,也太棒了!估计辉瑞大哥心情不好,2015年批准的Ibrance(Palbociclib)在2015年销售额达7.23亿美元,2016年第一季度飙升,销售额达4.29亿美元。这回来个强劲对手,自求多福吧!
批准
13日,Swedish Orphan Biovitrum AB (Sobi™)和 Biogen(百健)宣布,欧洲委员会(EC)已批准 Alprolix® (rFIXFc),其半衰期延长治疗B型血友病,维持其孤儿药资格。Alprolix 是一种抗体Fc-人凝血因子IX,用于治疗和预防B型血友病出血。
13日,Eisai(卫材)宣布,美国FDA批准 LENVIMA® (lenvatinib,乐伐替尼),多受体酪氨酸激酶抑制剂,与依维莫司联合治疗晚期肾细胞癌 (aRCC),且患者曾经接受过抗血管生成的治疗。批准是基于令人印象深刻临床研究结果,每天一次,18mg的LENVIMA 和 5mg的依维莫司联合使用,比依维莫司单独使用(这是接受抗血管生成治疗肾癌患者的标志护理),大幅度提高无进展生存 (PFS),强大的客观反应率 (ORR) 和具有临床意义的总生存期 (OS)。
17日,韩美Olmutinib,第一个TKI药物治疗EGFR T790M 突变阳性肺癌在韩国获得批准,2015年韩美将此药在韩国和中国以外地区的商业权利以“5千万美元预付款+6.8亿美元里程金+销售分成”的形式许可给了勃林格殷格翰。将中国的独家权许给再鼎。
17日,Actelion的Uptravi (selexipag) 治疗肺动脉高压获得欧盟上市批准。该药于去年12月获得美国FDA首批。
17日,百时美施贵宝宣布美国FDA批准 Opdivo (nivolumab) 治疗经典霍奇金淋巴瘤 (cHL)。这是nivolumab获批的第四个适应症,另外分别是黑素瘤、肾细胞癌、非小细胞肺癌,处于审批阶段的适应症还有头颈癌、胶质母细胞瘤、胃癌。
18日,罗氏旗下Genentech的PD-L1药物Atezolizumab获得美国FDA批准,用于膀胱癌的治疗。30多年来,这是FDA针对这一特定膀胱癌批准的首个新药,也是FDA批准的首个PD-L1抗体。而且,该药曾先后获得FDA的突破性疗法认定、优先审评资格、以及加速审批资格。同时,罗氏旗下Ventana的PD-L1(SP142)检测法也获得批准,以检测患者肿瘤浸润性免疫细胞的PD-L1蛋白表达量。