2018年10月1日,国际著名学术期刊Advanced Materials(《先进材料》)在线发表了我院宋海云课题组与欧洲杯竞猜平台化学化工学院樊春海课题组共同发表的论文“Programming Niche Accessibility and In Vitro Stemness with
Intercellular DNA Reactions”。该研究利用DNA纳米技术开发了一项构建体外干细胞巢的新技术--ESPN (expansion of stem cells with pairing niches)。这项技术的开发对于干细胞的体外培养以及体外条件下三维组织的重构具有非常重要的意义。
干细胞是一类具有自我复制能力的多潜能细胞。在一定条件下,它可以分化成多种功能细胞,因而在再生医学领域有着非常广阔的应用前景。由于干细胞数目较少且获取困难,将分选出来的干细胞通过体外培养进行扩增就显得尤为重要。然而,到目前为止,很多干细胞的体外培养仍然不够成熟,缺乏扩增效率,其中一个重要原因是体外培养环境中缺少促进干细胞自我更新的干细胞巢。
在本研究中,研究者们将从小鼠乳腺分选出来的乳腺干细胞和能够分泌Wnt蛋白的L-Wnt3a细胞用锚定于细胞膜表面的DNA链通过碱基互补连接后在模拟细胞外基质的Matrigel中培养,以期构建紧密相邻的干细胞-干细胞巢共培养体系。研究表明,这样的体外干细胞巢一方面可以通过机械力的调控激活乳腺干细胞内的YAP信号通路,另一方面也能够以旁分泌的形式激活乳腺干细胞内的Wnt信号通路,从而使得机械力调控和旁分泌调控同时作用于干细胞。结果显示,用这种方法构建的体外干细胞巢能够显著提高乳腺干细胞的克隆形成能力和干细胞增殖能力,一周以后培养的乳腺干细胞总数能够达到传统Matrigel培养方法的四倍以上。
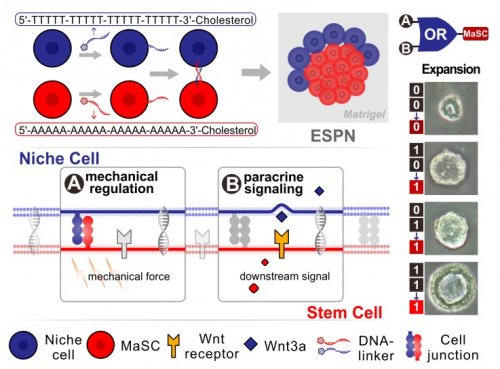
示意图:体外干细胞巢促进乳腺干细胞自我更新和扩增
李晓娇、谢晓东和马志伟为文章的共同第一作者。该研究工作得到科技部、国家自然科学基金委和中科院的资助。