近日,著名学术期刊Advanced Materials(影响因子32.1)在线发表了公共卫生学院宋海云研究员与季晓媛副研究员、欧洲杯竞猜平台化学化工学院樊春海院士和上海师范大学化学与材料科学院陈楠教授团队题为“Slimming and Reinvigorating Tumor-Associated Dendritic Cells with Hierarchical Lipid Rewiring Nanoparticles”的研究成果。该研究设计和构建了一种多层次脂质重编程纳米粒子,特异性地向肿瘤相关树突状细胞递送多种脂代谢干预药物,通过协同性地抑制外源性脂质摄取、内源性脂质合成和成脂基因转录等途径重塑肿瘤相关树突状细胞的抗肿瘤免疫功能,从而提出了一种重塑肿瘤浸润免疫细胞的新策略,显著提高了癌症免疫治疗效果。
肿瘤相关树突状细胞(TADCs)是抗肿瘤先天性免疫和适应性免疫的关键免疫细胞,然而外源性脂质摄取和内源性脂质合成的多途径脂质代谢机制可诱导TADCs产生免疫耐受,从而降低肿瘤对多种治疗策略的响应性。该研究利用聚己内酯-聚乙烯亚胺纳米粒子(PCL-PEI)的自组装特性,在疏水性内核中负载乙酰辅酶A羧化酶抑制剂(TOFA)和X-框结合蛋白mRNA剪切抑制剂(STF),并在亲水的纳米粒子表面通过静电作用装载脂质摄取抑制剂Fucoidan,构建了一种多层次脂质重编程纳米粒子。该纳米粒子表面包被的Fucoidan可以靶向TADCs表面的脂质转运受体Msr1并同时抑制外源性脂质摄取,而纳米粒子内化后释放的TOFA和STF分别抑制内源性脂质生物合成和脂质合成相关基因转录,三效合一重编程TADCs脂质代谢,从而缓解TADCs的免疫耐受并重塑其在炎性细胞因子分泌、细胞毒性T细胞募集和肿瘤抑制等方面的功能,进一步克服了肿瘤对免疫检查点阻断疗法的耐药性,为肿瘤免疫疗法提供了一种非传统模式的新方案(图1)。
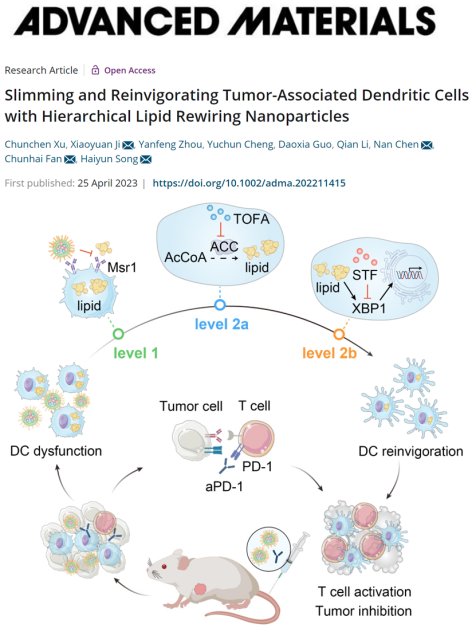
图1 多层次脂质重编程纳米粒子抗肿瘤策略示意图。图片来源:Adv. Mater.
TADCs中的脂质累积由多途径的脂质代谢异常介导,是其失去抗肿瘤免疫功能的关键因素。首先,TADCs细胞表面高表达的脂质转运受体Msr1促进了细胞外源性脂质摄取。其次,细胞质中活跃的脂质从头生物合成过程维持了TADCs中高水平的甘油三酯(TAG)。此外,肿瘤微环境高氧化压力的环境诱导TADCs中脂质过氧化副产物的累积,触发了内质网应激反应因子XBP1介导的脂质合成基因的转录水平上调,进一步促进了TADCs的脂质合成。由于脂质累积途径的复杂性,对 TADCs进行高效的脂代谢干预具有很大的挑战性。在本研究中,包被Fucoidan的纳米粒子特异性地靶向TADCs细胞膜表面受体Msr1并竞争性抑制外源性脂质摄取,此外内化的纳米粒子可释放TOFA和STF,分别抑制细胞质脂质从头合成和细胞核脂质合成相关基因转录,进而降低TADCs内源性脂质合成,达到三效合一的脂质干预效果。
在肿瘤微环境高脂质丰度的长期刺激下,TADCs尽管保留了抗原吞噬能力,但其向T细胞呈递抗原的能力大大受损,从而分化为耐受型表型(tolDCs),主要表现为细胞表面的共刺激分子(CD80、CD86和CD40)和抗原呈递分子MHC表达水平下降,以及炎性细胞因子IL-12、IL-6、TNFα和IFNα等分泌减少。这不仅抑制了效应T细胞的抗肿瘤免疫功能,而且促进了肿瘤免疫抑制微环境的形成。在本研究中,脂质重编程纳米粒子通过靶向TADCs的多层次脂质干预,提高TADCs呈递抗原和分泌炎性细胞因子的能力,进而诱导细胞毒性T细胞增殖与激活(图2)。
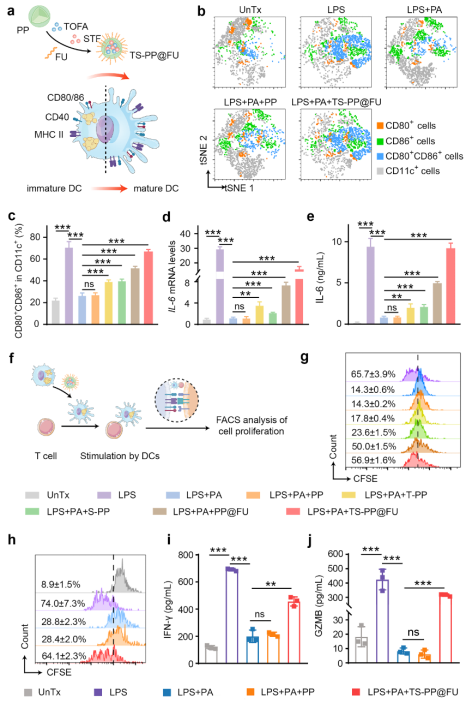
图2 多层次脂质代谢重编程纳米粒子重塑TADCs。图片来源:Adv. Mater.
在小鼠原位三阴性乳腺癌模型中,包被Fucoidan的纳米粒子能够更有效地富集于肿瘤部位并优先被TADCs内化,通过同时限制外源性脂质摄取和内源性脂质合成,协同降低TADCs的脂质丰度,从而逆转TADCs的免疫耐受表型并增强TADCs对细胞毒性T细胞的募集能力和抗肿瘤功效。此外,鉴于三阴性乳腺癌对免疫检查点抑制剂aPD-1的耐药性,研究发现多层次脂质重编程纳米粒子可增强小鼠三阴性乳腺肿瘤对aPD-1的药物敏感性并显著延长小鼠生存时间。这项研究提出了一种借助脂代谢重编程实现免疫细胞瘦身和功能重塑的策略,为肿瘤的免疫疗法提供了一种新思路和方法。
公共卫生学院宋海云研究员与季晓媛副研究员、欧洲杯竞猜平台化学化工学院樊春海院士和上海师范大学化学与材料科学院陈楠教授为该文的共同通讯作者。欧洲杯竞猜平台硕士研究生徐春辰和副研究员季晓媛为该论文的并列第一作者。