近日,著名学术期刊《Advanced Materials》(影响因子32.1)在线发表了公共卫生学院宋海云研究员、王慧教授、季晓媛副研究员和化学化工学院樊春海院士团队题为“Targeted Reprogramming of Vitamin B3 Metabolism as a Nanotherapeutic Strategy towards Chemoresistant Cancers”的研究成果。该研究利用肿瘤微环境响应性水凝胶递送平台装载双子纳米粒子,通过对肿瘤干细胞周围的壁龛基质肿瘤相关成纤维细胞的代谢重编程和表观遗传调控,阻断肿瘤干细胞干性维持因子和免疫抑制性细胞招募因子的分泌,诱导肿瘤干细胞分化和免疫激活,提高乳腺癌、肝癌、胰腺癌和结直肠癌在内的多种化疗耐药性肿瘤对一线化疗药物的响应性,有效抑制肿瘤生长并诱导长期免疫记忆。宋海云课题组近年来聚焦于肿瘤耐药的干预,针对肿瘤干细胞扩增和代谢异常等肿瘤微环境特征,通过设计新型生物材料,发展精准的表观遗传干预和代谢干预技术,增强肿瘤对化疗和免疫疗法的敏感性以及预防肿瘤的复发和转移,2023年已有3项重要成果发表于《Advanced Materials》。
肿瘤相关成纤维细胞(CAFs)通过合成细胞外基质蛋白,如I型胶原蛋白和纤黏蛋白等,在肿瘤干细胞周围形成阻碍药物进入的屏障。更重要的是,CAFs通过分泌细胞因子诱导肿瘤干细胞富集,维持肿瘤干细胞干性,促进肿瘤化疗耐受;同时分泌多种趋化因子招募免疫抑制性细胞(MDSC和Treg),产生免疫抑制性微环境。在本研究中,水凝胶释放的双子纳米粒子分别向CAFs递送烟酰胺N-甲基转移酶(NNMT)的干扰RNA和向肿瘤细胞递送化疗药物。其中,装载干扰RNA的纳米粒子表面包被了CAF细胞膜,通过同源靶向效应进入CAFs并沉默CAFs中高表达的NNMT,抑制异常的VB3代谢,重塑染色质的甲基化和去乙酰化修饰,进而阻断肿瘤干细胞干性维持因子和免疫抑制性细胞招募因子的表达,诱导肿瘤干细胞分化和免疫激活;装载化疗药物的纳米粒子表面经肿瘤细胞膜伪装,可靶向和杀死已分化的肿瘤细胞。通过双纳米粒子的协同作用可实现肿瘤的完全消退(图1)。
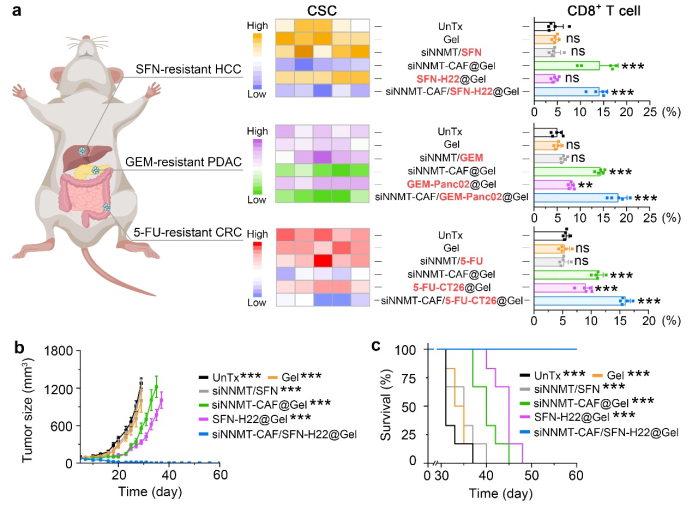
在化疗耐药性乳腺癌、肝癌、胰腺癌和结直肠癌小鼠模型中,水凝胶介导的双靶向纳米递药体系能够显著降低肿瘤干细胞和免疫抑制性细胞的丰度,增强杀伤性T细胞对肿瘤的浸润,逆转肿瘤对化疗药物的耐受性,避免肿瘤导致的死亡(图2)。这项研究提供了一种具有广谱适用性的、基于肿瘤基质细胞VB3代谢重编程的化疗耐药性肿瘤治疗策略。
公共卫生学院宋海云研究员、王慧教授、季晓媛副研究员和欧洲杯竞猜平台化学化工学院樊春海院士为该文的共同通讯作者。欧洲杯竞猜平台博士研究生郭道霞和副研究员季晓媛为该论文的并列第一作者。