我国人口正逐步进入重度老龄化阶段,2035年60岁及以上老年人口将破4亿,占比超过30%。阿尔茨海默症(AD,俗称老年痴呆)是最典型的一种神经退行性疾病,成为世界性的医疗难题。绝大多数AD的发病驱动力主要来自于风险遗传变异与环境风险因素(如感染、脑创伤、空气污染等)之间复杂且长期的相互作用。在传染病疫情频发(如新冠大流行)背景下,神经感染与老年性脑疾病的潜在致病相关性受到关注。
近日,欧洲杯竞猜平台附属松江医院、欧洲杯竞猜平台松江研究院、中国科学院昆明动物研究所曾健雄课题组与哈尔滨医科大学第四附属医院马学玲教授合作在Molecular Psychiatry杂志发表了题为“Microbial infection promotes amyloid pathology in a mouse model of Alzheimer’s disease via modulating γ-secretase”的研究论文,揭示了普遍感染人群的疱疹病毒(HSV-1)中枢感染促进阿尔茨海默症病理进程的分子机制。
人群全基因组关联分析(GWAS)结果发现 (1, 2),已知的AD风险基因大部分参与免疫过程,提示AD风险相关遗传变异可能通过影响免疫反应贡献于AD发病。最近领域内学者提出了一种AD发病模型,即Aβ和神经炎症之间的相互作用促进tau蛋白缠结扩散 (3),强调了Aβ、tau、神经炎症三者之间存在非常紧密的生物学联系,凸显了神经免疫与炎症在AD发病过程中的重要作用。事实上,免疫反应最直接的诱发因素是病原体感染,后者同时也是一种AD发病的环境风险因素,部分AD患者脑内确实检测到疱疹病毒HSV-1等病原体 (4-7),进一步的人群队列分析也表明感染史显著增加痴呆发生风险 (9)。由此提出的AD感染假说 (10)认为,病原体慢性感染是AD病变的驱动性原因之一。HSV-1是一种可终身潜伏的嗜神经性DNA病毒,其在人群中感染率可达80%以上,通常在三叉神经节内建立潜伏状态,并可在多种免疫刺激下周期性重激活。不论是流行病学调查、临床队列研究亦或是针对痴呆风险的抗病毒治疗均证明,HSV-1与AD病因息息相关。然而,受制于疱疹病原感染特性、动物模型缺乏等多种因素,HSV-1感染与AD致病的因果关系至今仍不清楚。因此,对于这一科学问题的研究,将有助于认识AD发病机制,也为AD潜在人群规避感染风险提供科学指导。
研究团队首先利用改造的HSV-1局部感染淀粉样病变模型5×FAD小鼠,海马体免疫荧光染色分析发现感染促进Aβ生成、胶质细胞激活和神经炎症。然而,与淀粉样前体蛋白(APP)加工最为相关的γ-分泌酶相应组分PS1、PEN2等的蛋白表达水平总体上无显著变化,这提示HSV-1感染诱发的Aβ病理可能与γ-分泌酶组分表达水平相关性较小。因此研究人员提出科学假设,即HSV-1可能是通过调控γ-分泌酶活性进而促进神经退行性病变。免疫共沉淀实验发现HSV-1病毒糖蛋白US7可与γ-分泌酶相互作用,而HSV-1其它膜蛋白(如UL1、UL34和UL56)不具有与γ-分泌酶结合的能力,提示US7特异性与γ-分泌酶结合。利用多种细胞模型进行的功能性实验发现,US7可通过调节γ-分泌酶活性促进Aβ产生。进一步利用5×FAD模型,腺病毒相关病毒(AAV)递送的US7在5×FAD小鼠海马体过表达,实验结果发现US7表达促进Aβ生成及神经炎症发生,加速Aβ病理,导致神经细胞功能异常与神经退行性病变。这项研究从分子机制、神经细胞、动物模型等多层面揭示了HSV-1感染与AD相关神经退行性病变的分子机制,为微生物感染促进神经退行性疾病机理提供了科学见解。
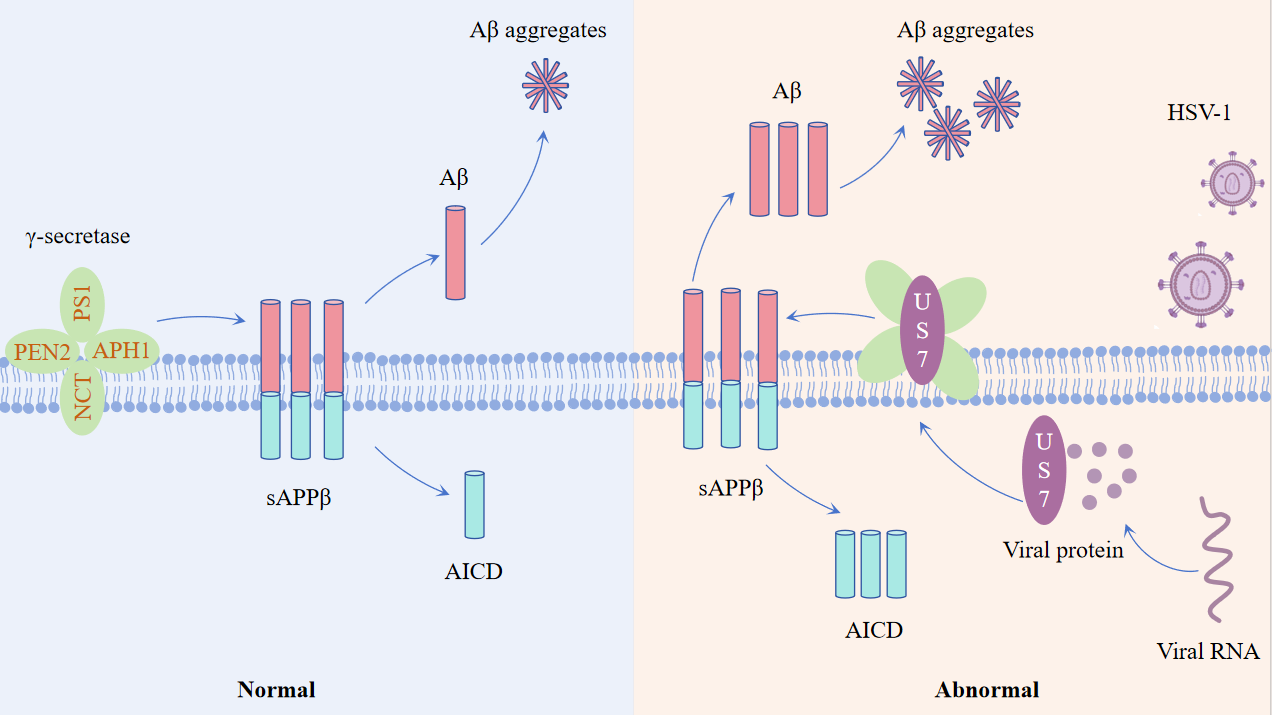
图1 疱疹病毒HSV-1膜蛋白US7调节γ-分泌酶活性促进Aβ病理
博士生赵萌、马官芹、闫晓旭、科研助理李晓红为该论文共同第一作者,曾健雄研究员和马学玲教授为论文共同通讯作者。该研究得到国家科技部、国家自然科学基金、黑龙江省自然科学基金、云南省基础研究计划等项目的资金支持。
参考文献:
1. E. Cuyvers, K. Sleegers, Genetic variations underlying Alzheimer's disease: evidence from genome-wide association studies and beyond. Lancet Neurol 15, 857-868 (2016).
2. D. F. Zhang et al., Complement C7 is a novel risk gene for Alzheimer's disease in Han Chinese. Natl Sci Rev 6, 257-274 (2019).
3. T. A. Pascoal et al., Microglial activation and tau propagate jointly across Braak stages. Nat Med 27, 1592-1599 (2021).
4. G. A. Jamieson, N. J. Maitland, G. K. Wilcock, J. Craske, R. F. Itzhaki, Latent herpes simplex virus type 1 in normal and Alzheimer's disease brains. J Med Virol 33, 224-227 (1991).
5. M. A. Wozniak, A. P. Mee, R. F. Itzhaki, Herpes simplex virus type 1 DNA is located within Alzheimer's disease amyloid plaques. J Pathol 217, 131-138 (2009).
6. K. S. Levine et al., Virus exposure and neurodegenerative disease risk across national biobanks. Neuron 111, 1086-1093 (2023).
7. B. Readhead et al., Multiscale Analysis of Independent Alzheimer's Cohorts Finds Disruption of Molecular, Genetic, and Clinical Networks by Human Herpesvirus. Neuron 99, 64-82 (2018).
8. K. Nielsen-Saines et al., Delayed childhood neurodevelopment and neurosensory alterations in the second year of life in a prospective cohort of ZIKV-exposed children. Nat Med 25, 1213-1217 (2019).
9. P. N. Sipila et al., Hospital-treated infectious diseases and the risk of dementia: a large, multicohort, observational study with a replication cohort. Lancet Infect Dis 21, 1557-1567 (2021).
10. M. Wainberg et al., The viral hypothesis: how herpesviruses may contribute to Alzheimer's disease. Mol Psychiatr 26, 5476-5480 (2021).
