近日,欧洲杯竞猜平台附属国际和平妇幼保健医院赖东梅教授团队在eClinicalMedicine在线发表题为Safety and efficacy of allogenic human amniotic epithelial cells transplantation via ovarian artery in patients with premature ovarian failure: a single-arm, phase 1 clinical trial(人羊膜上皮干细胞经卵巢动脉移植治疗卵巢早衰患者的安全性和有效性:单臂1期临床试验)的研究论文。本研究是一项早期探索性单臂阶段临床试验,证实了通过卵巢动脉进行人羊膜上皮干细胞(hAECs)移植在治疗卵巢早衰患者是安全的、耐受性良好,并显示初步有效性,是卵巢功能下降患者的潜在新的疗法。欧洲杯竞猜平台临床研究中心王炳顺教授作为该研究的方法学专家,自项目伊始方案设计到后期数据分析统计,全程给予方法学支持,确保研究安全、有效开展。

早发性卵巢功能不全/卵巢早衰(Premature ovarian insufficiency/failure, POI/POF)是40岁之前的女性出现卵巢功能下降为特征的疾病,表现为月经稀发、闭经,伴有血清促卵泡激素(FSH)升高和雌二醇(E2)水平降低。全球约有3.5%的女性罹患该疾病,【1】POF是疾病的终末期。POF不但导致不孕,而且使机体提早10~30年进入衰老阶段,患者发生心脑血管疾病、骨质疏松症、免疫系统疾病等风险显著升高,导致寿命缩短,严重影响患者的身心健康和家庭稳定。因此,卵巢过早衰老,意味着机体多个组织和器官将同时进入衰老阶段。然而,目前POF没有很好的治疗方法,迫切需要探索新的治疗策略。
团队之前的研究表明,hAECs可以显著增强化疗诱导或免疫损伤的POF小鼠模型的卵巢功能和改善生育能力。植入的hAECs向损伤卵巢迁移,通过旁分泌因子或外泌体抑制颗粒细胞凋亡,促进血管生成,改善卵巢微环境,从而促进卵巢功能修复【2-5】
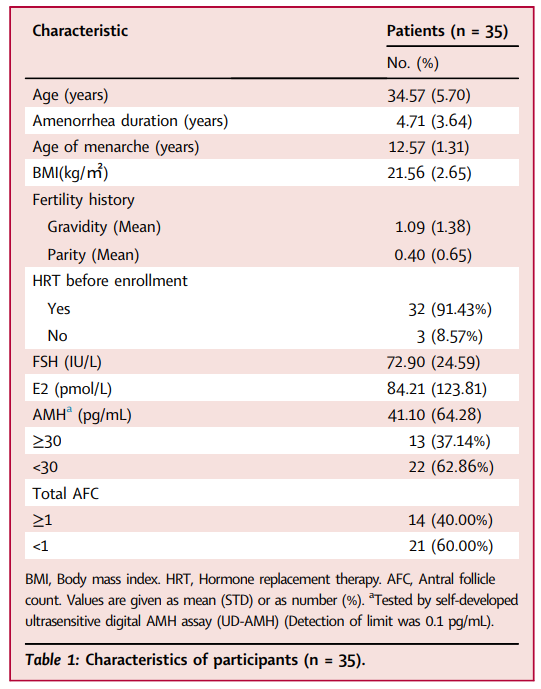
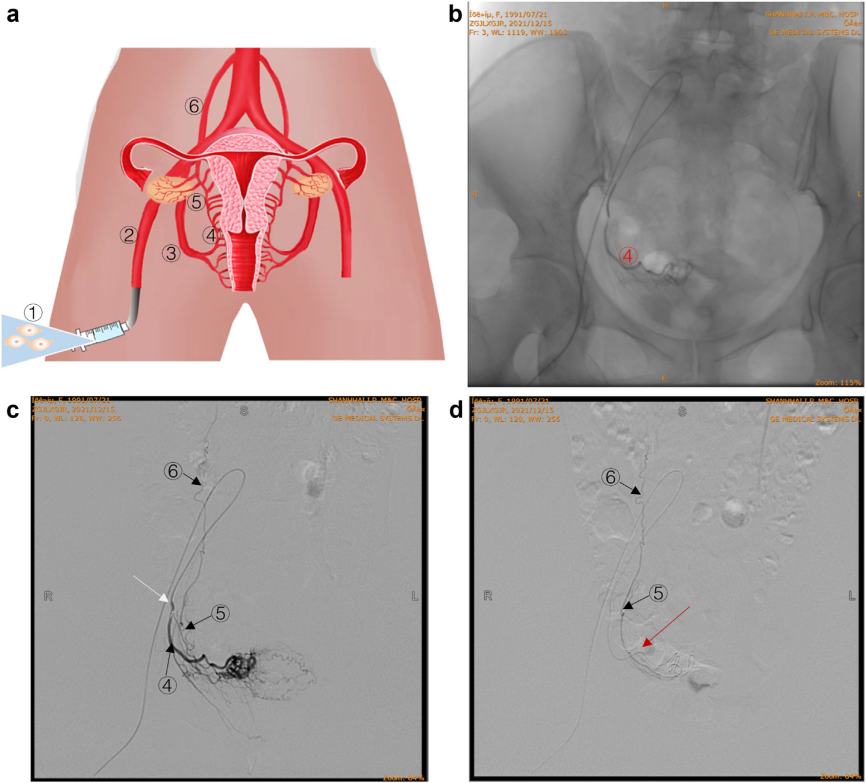
临床试验入组了35例POF受试者,每名受试者经双侧卵巢动脉共接受了单次6×107 hAECs注射,并在治疗后不同时间间隔进行随访评估,包括治疗后大约1个月 (Visit-1, V-1)、3个月 (Visit-2, V-2) 和5个月 (Visit-3, V-3)。
本试验的主要目的是评估经卵巢动脉内输注hAECs的安全性和耐受性,包括不良反应(AE)的发生,严重不良事件的发生 (SAEs),特别关注的AE包括急性过敏反应,或与治疗相关的肿块形成;与hAECs移植相关的临床症状与体征,包括生命体征、体格检查、血常规、凝血功能、肝肾功能、胸片和心电图检查等。次要终点指标包括卵巢功能修复相关指标,如超声检查子宫内膜厚度、卵巢体积、窦卵泡计数、性激素水平、绝经期生活质量 (MENQOL) 量表以及生育指标等。
临床研究试验结果表明,在5个月的随访期间未观察到严重不良反应。最常见的AE为与介入操作相关的局部血肿 (7/35, 20.00%),盆腔疼痛 (4/35, 11.43%)、发热(2/35, 5.71%)、过敏反应 (2/35, 5.71%) 和肝功能异常 (1/35, 2.86%)。这些不良反应基本都是轻微的、暂时的和一过性的,经对症治疗可缓解并恢复正常。干细胞给药的主要途径包括静脉给药、原位注射和动脉给药。研究首次尝试了在POF病人中开展经卵巢动脉注射干细胞的给药途径。目前发现,这种给药方法是可行且安全的。相比于原位注射,这种方法不受限于卵巢体积的大小和卵巢的硬度。
有效性方面,hAECs移植后,在5个月的随访期间,所有患者的子宫内膜厚度、卵巢体积、性激素 (FSH和E2) 水平和围绝经期质量MENQOL评分均有显著改善。其中13例 (37.14%) 出现自发性月经,7例患者(7/35)报告hAECs移植后恢复至少两次规律月经。hAECs治疗后1个月,与治疗前比较,治疗有效组患者的子宫内膜厚度、左侧卵巢体积、FSH、E2、卵巢储备指标抗苗勒氏管激素 (AMH) 水平和MENQOL评分均有显著改善。本项临床试验结果显示,hAECs移植在POF患者中的应用安全性良好且初步有效。
抗苗勒氏管激素AMH是评估卵巢功能的客观指标,其检测值不受月经周期或者激素等服用药物的影响。该研究中,大部分受试者AMH极低以至于超出目前常用的临床检测方法的检测极限。赖东梅教授研究团队与欧洲杯竞猜平台徐宏教授合作,自主研发了基于数字式的超敏AMH检测方法(UD-AMH)。本研究采用UD-AMH检测方法,可精确评估所有患者的AMH值,从而实现了对干细胞移植治疗前后AMH变化的进一步统计分析。值得注意的是,正如患者基线AMH水平所提示的,治疗的有效性可能与患者尚存的基线卵巢储备有关。患者基线卵巢储备在决定干细胞治疗的有效性方面或许起到关键作用,但未来仍需要进一步进行更长随访期、更大样本量的hAECs随机对照试验。总体而言,本研究为POF患者带来了新的潜在治疗方法,期待在不久的未来可以造福更多患者家庭。
国际和平妇幼保健院翁丽纯博士、韦柳彤博士、张秋婉博士、孙陶陶博士为论文共同第一作者,赖东梅教授、钱朝霞教授以及欧洲杯竞猜平台临床研究中心王炳顺教授为共同通讯作者。
原文链接(点击下方链接查看):
https://www.thelancet.com/journals/eclinm/article/PIIS2589-5370(24)00323-7/fulltext
参考文献
1. Li M, Zhu Y, Wei J, Chen L, S Chen, Lai D. The global prevalence of premature ovarian insufficiency: a systematic review and meta-analysis. Climacteric 2022; 26(2): 95-102.
2. Wang F, Wang L, Yao X, Lai D, Gu L. Human amniotic epithelial cells can differentiate into granulosa cells and restore folliculogenesis in a mouse model of chemotherapy-induced premature ovarian failure. Stem Cell Res Ther. 2013; 4(5): 124.
3. Zhang Q, Bu S, Sun J, et al. Paracrine effects of human amniotic epithelial cells protect against chemotherapy-induced ovarian damage. Stem Cell Res Ther. 2017; 8(1): 270.
4. Zhang Q, Huang Y, Sun J, Gu T, Shao X, Lai D. Immunomodulatory effect of human amniotic epithelial cells on restoration of ovarian function in mice with autoimmune ovarian disease. Acta Biochim Biophys Sin. 2019; 51(8): 845-855.
5. Zhang Q, Sun J, Huang Y, et al. Human Amniotic Epithelial Cell-Derived Exosomes Restore Ovarian Function by Transferring MicroRNAs against Apoptosis. Mol Ther Nucleic Acids. 2019; 16: 407-418.
新闻来源:BioArtMED微信公众号

