
年纪大了,关节疼痛的情况就会比较明显;年纪大了,不可避免会有骨质疏松的问题;年纪大了,多少就会有些退行性骨病……在大家的普遍认知中,“骨头不好”这个锅就应该是“年龄”来背,但根据上海市第六人民医院骨科张长青教授团队的最新研究显示,“骨头不好”可能只是由于其内在的协同机制出现了问题,而并非就一定是“坏了”、“死了”。近期,附属第六人民医院张长青教授、高俊杰博士,西澳大利亚大学郑铭豪教授,东京大学Hiroshi Takayanagi教授合作的研究成果发表在《科学》子刊《科学先进》(Science Advances,影响因子12.804)上。此项研究通过揭示骨细胞之间重要的能量协同机制,将有助于临床寻找到治疗骨退行性疾病的新方法。
据悉,骨细胞是骨生长以及重构过程中极为重要的调控细胞,由成骨细胞分化而来,成熟后包埋在骨的矿化基质中。骨细胞通过突触网络相互连接,调控破骨细胞的溶骨和成骨细胞的成骨作用。“我们人体内的骨细胞生活在一个低氧的环境中,一般来说其寿命长达50年左右。”张长青教授介绍,“骨细胞中有很多线粒体的存在,线粒体就好比是电池,为骨细胞提供生命活动所必要的能量。我们经常说年纪大了骨质变差了,其实就是因为大量的线粒体损伤及无法转移引发了骨细胞的衰老。”
那如何才能减缓甚至是修复线粒体的损伤呢?在这项基于骨细胞的研究中,研究人员发现线粒体大量分布在骨细胞的突触网中,并且在老龄化过程中,线粒体的分布呈现明显的下降趋势。伴随年龄增长,线粒体的活性降低,其转移能力也降低了。通过构建线粒体荧光标记的转基因小鼠和体外骨细胞3D共培养技术,研究人员发现,通过线粒体间的传递与转移,可以达到相互协同、支援的效果,从而恢复受损骨细胞的能量代谢。
张长青教授进一步解释,通过活细胞荧光成像技术,研究人员发现线粒体的传递过程依赖着线粒体与内质网的接触。如果把线粒体比作是能量,那么内质网就是转运能量的传输带。当线粒体与内质网的接触蛋白Mfn2受到抑制,健康细胞传递线粒体的能力也明显受到影响。值得注意的是,在老龄化过程中,Mfn2确实表现为在骨细胞中的表达量呈现明显降低的趋势。
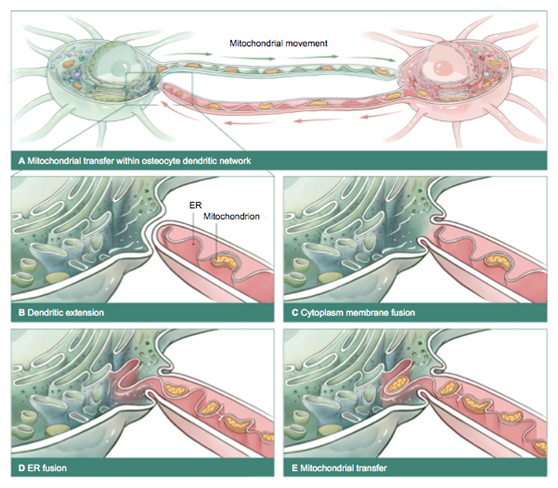
从关注骨病的治疗,到关注骨病的发病机制,张长青教授团队的这项研究揭示了线粒体与内质网的接触调控着骨细胞之间重要的能量协同机制,将为治疗骨退行性疾病打开了新局面,为骨质疏松、骨坏死等领域的研究提供潜在调控靶点,从而在临床应用中通过提前干预为老年性骨病的诊治前置防线。

