近日,著名学术期刊Advanced Materials发表了欧洲杯竞猜平台公共卫生学院宋海云研究员、化学化工学院樊春海院士与西安交通大学药学院张继业教授团队题为“Composite Hydrogel for Spatiotemporal Lipid Intervention of Tumor Milieu”的研究成果。该研究构建了一种响应肿瘤微环境的智能型复合水凝胶,靶向肿瘤组织内不同的细胞类型分别递送载药纳米粒子和游离药物,并结合近红外光热治疗,通过对肿瘤微环境的时空脂质干预发展了新的肿瘤免疫疗法。
免疫原性细胞死亡(ICD)在肿瘤免疫治疗中扮演着不可或缺的角色。然而,癌细胞中存在的双重抗脂质氧化机制可以抑制ICD的产生,而免疫抑制细胞中存在的异常脂质代谢也严重妨害了免疫系统对ICD的感知。该研究发现中空介孔硫化铜纳米粒子(CuS NPs)具有抑制谷胱甘肽过氧化物酶4(GPX4)的内在生物学特性,当其负载铁死亡抑制蛋白1(FSP1)的抑制剂(iFSP1)时,能平行地阻断癌细胞内两条抗脂质氧化的信号通路,再结合近红外辐射后可以三效合一地促进癌细胞的脂质过氧化和增强ICD。研究人员进一步制备了一种肿瘤微环境响应型水凝胶来共同递送靶向癌细胞的CuS NPs和靶向免疫抑制细胞的脂质吸收抑制剂(SSO),对肿瘤内的不同细胞群进行时空可控性的脂质干预。负载iFSP1的CuS NPs通过促进脂质过氧化产生ICD信号,SSO通过重塑脂质代谢恢复免疫监测,二者协同诱导先天性和适应性免疫并抑制肿瘤的生长、复发及转移,从而发展了一种新型的基于脂质干预的肿瘤免疫代谢疗法(图1)。
图1复合水凝胶抗肿瘤策略示意图。图片来源:Adv. Mater.
铁死亡是一种由脂质过氧化引起的ICD。当人们熟知的system xc-/glutathione/GPX4抗氧化信号通路被抑制时,会导致脂质过氧化物的累积。然而这种情况下,许多种类的癌细胞可以通过一条平行的FSP1/NAD(P)H抗氧化途径来避免铁死亡的产生,从而减弱了ICD信号的强度和肿瘤免疫疗法的疗效。本研究中,靶向肿瘤细胞的CuS NPs自身固有的抑制GPX4特性与负载的iFSP1平行诱导脂质过氧化作用。同时,CuS NPs的光热效应可协同增强ICD。
除癌细胞自主性地限制ICD外,癌细胞特有的代谢特性创造了具有免疫抑制性的肿瘤微环境(TME),从而削弱免疫系统对ICD信号的感知,导致免疫逃逸。TME中产生大量的脂质代谢产物并在M2型肿瘤相关巨噬细胞(M2-TAMs)、髓源抑制性细胞(MDSCs)和调节性T(Treg)细胞等免疫抑制细胞中异常积累,促进其分化和发挥免疫抑制功能。该类细胞所共有的特征是细胞表面高表达CD36受体,负责摄取脂质作为细胞主要能量来源。因此,阻断脂质摄取可通过代谢重编程限制这类免疫抑制性细胞的功能,恢复免疫监测。在本研究中,水凝胶中释放的SSO可靶向M2-TAMs、MDSCs和Treg细胞表面的CD36受体,阻断脂质摄取,重塑细胞功能,解除TME的免疫抑制,从而促进细胞毒性T淋巴细胞的浸润(图2)。
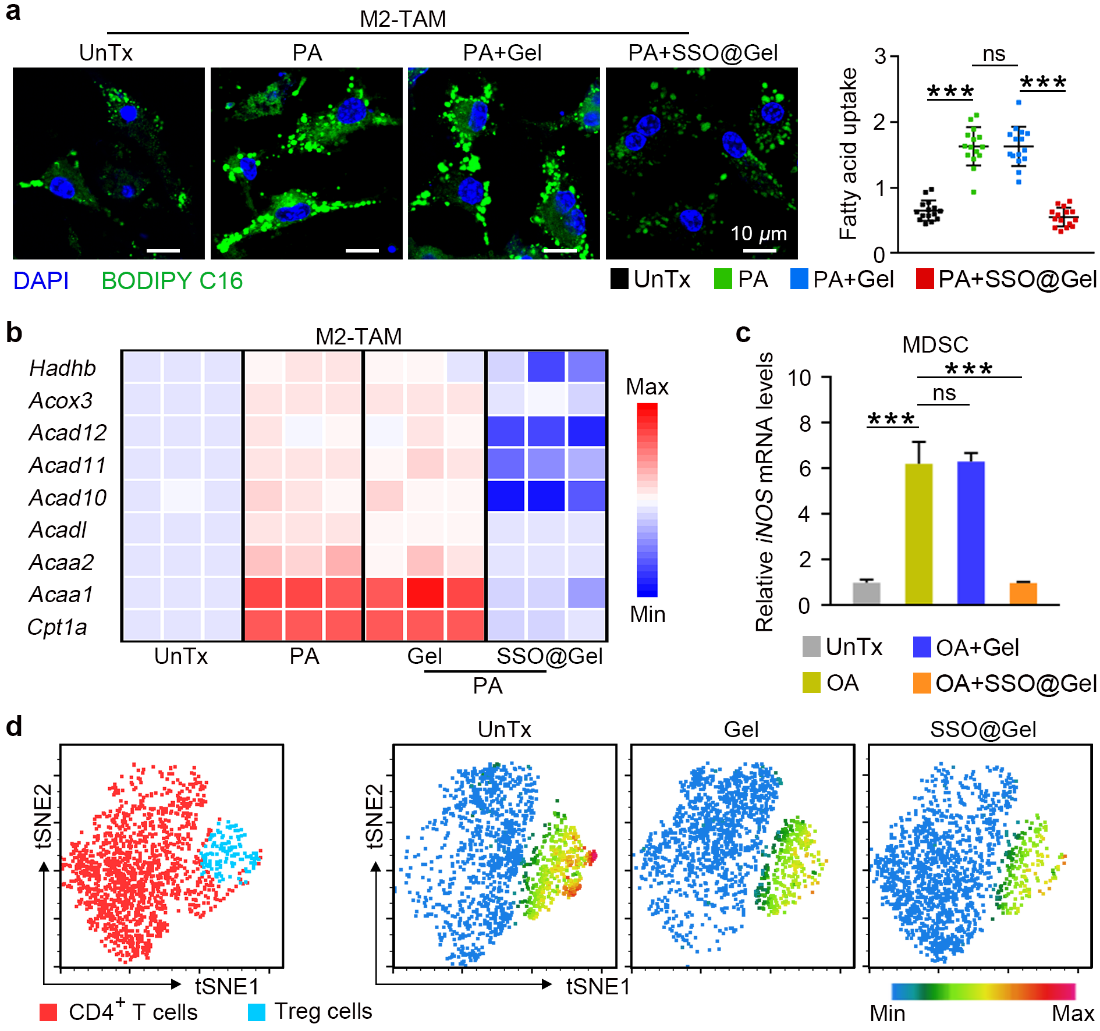
图2水凝胶通过脂质干预重塑免疫抑制细胞。图片来源:Adv. Mater.
在小鼠三阴性乳腺癌模型中,同时递送CuS NPs和SSO的复合水凝胶通过双管齐下的方法对肿瘤细胞和免疫抑制细胞进行调控,分别增强ICD信号和ICD感知,协同触发先天性和适应性免疫以抑制肿瘤的发展进程。此外,在小鼠乳腺癌切除模型中,该复合水凝胶能够有效抑制肿瘤的术后复发和转移。这项研究提出了一种时空干预肿瘤微环境脂质代谢的新策略,为肿瘤的免疫疗法提供了一种全新的思路和方法。
欧洲杯竞猜平台公共卫生学院宋海云研究员、化学化工学院樊春海院士和西安交通大学药学院张继业教授为该文的共同通讯作者。西安交通大学博士研究生马佳、欧洲杯竞猜平台博士研究生郭道霞和副研究员季晓媛为该论文的并列第一作者。

