
新年伊始,2020年1月24日,《自然》子刊Nature Communications在线发表了欧洲杯竞猜平台徐天乐教授课题组题为《Disruption of auto-inhibition underlies conformational signaling of acid-sensing ion channel 1a (ASIC1a) to induce neuronal necroptosis》的研究论文。该文展示了徐天乐课题组在研究脑卒中(缺血性中风)引起的神经元死亡机制方面取得的最新进展。博士后王晶晶和博士研究生刘凡在徐天乐教授、得克萨斯大学朱曦教授和胡琴副研究员的指导下,运用酸毒性细胞模型以及缺血性中风动物模型,结合蛋白质组学、蛋白质结构建模、活细胞成像等技术,揭示了酸敏感离子通道ASIC1a通过胞内结构域动态变构,介导酸毒性神经元程序性坏死的“代谢型门控”新机制。
神经元是包括人类在内的所有高等动物不可或缺的一类终末分化细胞,其不可再生性是许多神经系统疾病致残和致死的重要原因,故神经元的死亡机制和神经保护机制一直是神经科学研究的重大课题。酸毒是神经元死亡的一大诱因,组织酸化所致酸毒性神经元损伤常见于创伤性脑损伤、脑卒中和神经退行性疾病等。徐天乐课题组前期工作表明,ASIC1a是中枢神经系统分布广泛的关键组织酸化感受器,介导脑卒中引起的酸毒性神经元死亡。长期以来,ASIC1a作为离子通道介导的细胞内Ca2+超载被认为是其导致神经损伤的唯一机制(即“离子型门控”死亡机制)。2015年,徐天乐课题组率先发现质子除了激活ASIC1a通道的“离子型门控”死亡机制外,还能引起通道蛋白的整体变构,导致ASIC1a的C末端CP-1序列特异性结合RIPK1,使后者发生磷酸化,启动细胞程序性坏死(王宜之,王晶晶等, eLife, 2015)。这一过程并不依赖ASIC1a传统的离子通道功能。然而,由于包含C末端的ASIC1a全长蛋白质结构尚未被解析,其“代谢型门控”死亡机制的分子机理成为悬而未决的关键问题:即生理条件下,ASIC1a的C末端CP-1序列为何不直接引起神经元死亡?组织酸化如何使CP-1序列活化?CP-1序列是直接与RIPK1结合还是需要其他分子伴侣参与?这些难题亟待解决。
在最新的研究中,研究人员通过Rosetta计算机建模、荧光能量共振转移(FRET)以及药理学和基因操作等手段,发现ASIC1a通道胞内N末端和C末端存在基于蛋白相互作用的自抑制,即ASIC1a的N末端大量带负电荷的谷氨酸位点(E6EEE9)通过静电吸引力与其C末端CP-1序列中带正电荷的赖氨酸位点(K468,K471和K474)相互结合;当以电中性的丙氨酸代替谷氨酸(E/A突变)后,ASIC1a的N末端即与C末端解离。在组织酸化刺激下,通过招募NSF蛋白(N-ethylmaleimide-sensitive fusion ATPase, N-乙基-顺丁烯二酰亚胺敏感性融合ATP酶)结合并稳定N末端,导致其从C末端解离,暴露CP-1序列,NSF与游离的N端结合使CP-1持续暴露,从而实现C末端与RIPK1的结合并启动细胞程序性坏死。该研究不仅完整解析了ASIC1a通道“代谢型门控”死亡机制的结构基础,还基于通道胞内N末端氨基酸序列设计和筛选出一系列神经保护肽,为推动脑疾病基础研究向临床转化和促进脑卒中治疗新药开发提供了新思路。该研究对其它伴有组织酸化的神经系统疾病如多发性硬化症,亨廷顿氏症、老年痴呆等退行性疾病的防治也具有一定的借鉴和指导意义。
这项工作由欧洲杯竞猜平台王晶晶博士和刘凡博士研究生作为共同第一作者完成,徐天乐教授,朱曦教授和胡琴副研究员为共同通讯作者,同时还得到了浙江大学欧洲杯竞猜平台杨帆教授的合作支持。
该研究得到了国家自然科学基金委,上海市科委,上海市教委,美国NIH基金以及中国博士后基金等的支持。
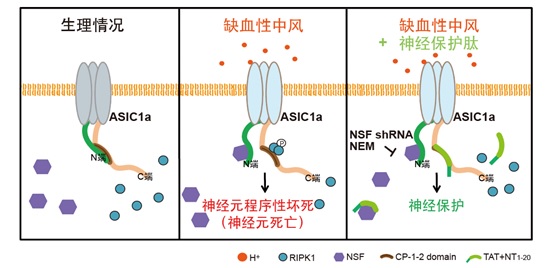
插图:离子通道ASIC1a介导酸毒性神经细胞程序性坏死的分子机制。
原文链接:https://www.nature.com/articles/s41467-019-13873-0

