
化疗与光疗(光动力治疗PDT或光热治疗)联合治疗(chemophototherapy)在实体肿瘤治疗中显示出很好的应用前景。铂纳米粒(nano-Pt)作为一种拟过氧化氢酶(CAT)的纳米酶(nanozyme),可通过催化肿瘤部位的过氧化氢(H2O2)供氧(O2),克服PDT疗效受到的肿瘤缺氧微环境的制约。铂纳米粒还可通过浸出铂离子作为化学治疗剂杀伤肿瘤细胞。然而,现今研究报道一直关注铂纳米粒的CAT或化疗活性,如何在实体肿瘤PDT中发挥其协同效应亟待探索。
典型的铂纳米粒的递送方法是将它们通过原位生长的方式附着在其他治疗用纳米载体上,由于这些载体尺寸较大(90-130 nm),渗透进入肿瘤深部的作用较弱,铂纳米粒对深部肿瘤细胞的化疗毒性作用受到限制。因此,如何既使小粒径铂纳米粒保持自由状态(不受现有原位生长方法的限制),实现对肿瘤组织的有效渗透,同时又对它们进行高效地装载和递送是面临的主要挑战。
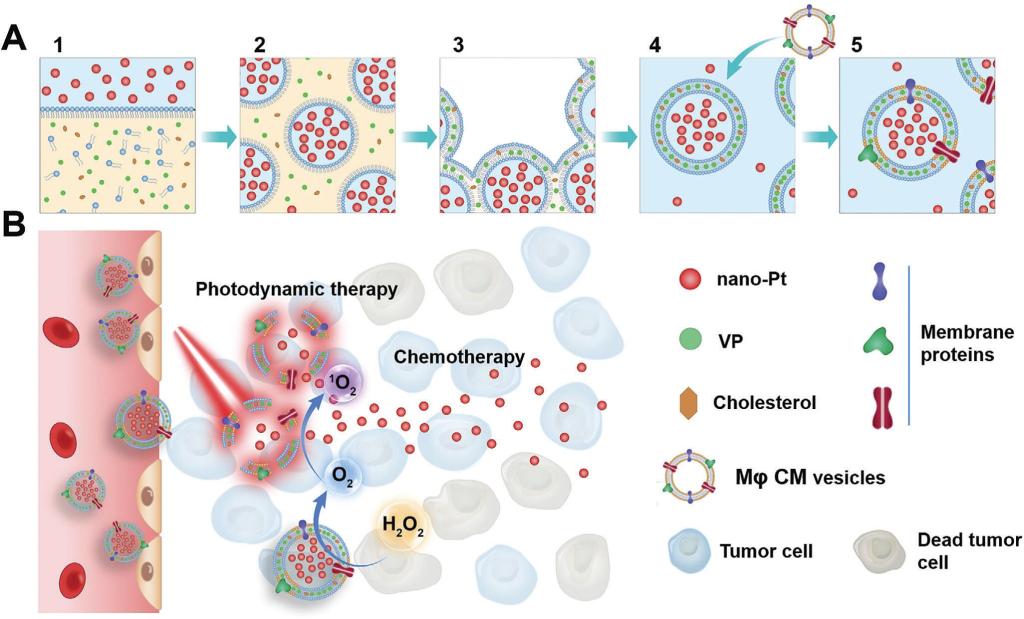
近日,欧洲杯竞猜平台方超教授团队等在Advanced Science期刊上以封面(Cover Picture)形式发表题为“Biomimetic Liposomal Nanoplatinum for Targeted Cancer Chemophototherapy”的论文。研究人员通过逆相蒸发(reverse phase evaporation)技术成功地将亲水性、超小尺寸的铂纳米粒(3-5 nm)包封在脂质体内水腔中(包封率46%),脂质双层荷载疏水性临床批准的光敏剂维替泊芬(VP),进一步与巨噬细胞的细胞膜杂交,得到具有长循环和炎性内皮(例如肿瘤血管)靶向的仿生铂纳米粒脂质体。
在肿瘤部位,铂纳米粒催化产生的氧气(O2)可增强VP介导的PDT。反过来,PDT通过增强脂质体膜的通透性,触发铂纳米粒“超快速”释放(光照5 min,释放> 95%)。超小的铂纳米粒进而可渗透进入肿瘤组织。有趣的是,催化产生的O2也会增强铂纳米粒的运动性和肿瘤渗透作用,增强化疗作用。小鼠实验中,单次注射仿生铂纳米粒脂质体结合光照可高效抑制侵袭性4T1乳腺肿瘤的生长(抑制率90%)及其肺转移(抑制率100%),延长动物存活时间(中位生存期延长72%)。剂量爬升实验和安全性评价研究显示,铂纳米粒脂质体治疗方案耐受性好,没有明显的毒副作用。该研究工作为肿瘤多模式联合治疗和抗肿瘤药物高效共递送系统的设计提供了新思路。
欧洲杯竞猜平台基础欧洲杯竞猜平台博士研究生刘学良为论文的第一作者,欧洲杯竞猜平台方超教授和上海中医药大学陈红专教授为该论文的通讯作者。美国University at Buffalo(SUNY)Jonathan F. Lovell教授和加拿大多伦多大学郑岗(Gang Zheng)教授给予了重要支持和帮助。该研究得到国家自然科学基金和上海市科委项目的资助。

