
肝损伤和细胞死亡是所有肝脏疾病的共同特征。肝移植是终末期肝病的一种既定的治疗方法。然而,由于器官移植的技术特征,肝移植过程中的缺血/再灌注损伤(Hepatic ischemia-reperfusion,I/R)是肝脏外科手术过程中最具有挑战性的问题之一,其可诱发肝细胞损伤进而导致严重的细胞死亡。铁死亡(ferroptosis)作为一种铁离子依赖的新型细胞程序性死亡,以铁稳态(iron homeostasis)的破坏和脂质活性氧(reactive oxygen species, ROS)的积累为主要特征。现有的研究证明,铁死亡广泛参与氧化应激引起的多种相关疾病,包括缺血再灌注损伤和神经退行性疾病等。然而,目前对于铁死亡在病理过程中的分子机制和生物学功能仍不明确。
3月8日,欧洲杯竞猜平台病理生理学系张晶课题组联合钟清课题组以及欧洲杯竞猜平台附属仁济医院夏强团队在国际知名期刊Cell Death & Differentiation上发表了题为Ubiquitin ligase E3 HUWE1/MULE targets transferrin receptor for degradation and suppresses ferroptosis in acute liver injury的研究论文。在本研究中,研究人员系统深入地解析了急性肝损伤过程中铁死亡关键蛋白转铁蛋白受体TfR1的泛素化修饰调控,并为临床上缓解肝移植过程中的急性肝损伤提供新的思路。
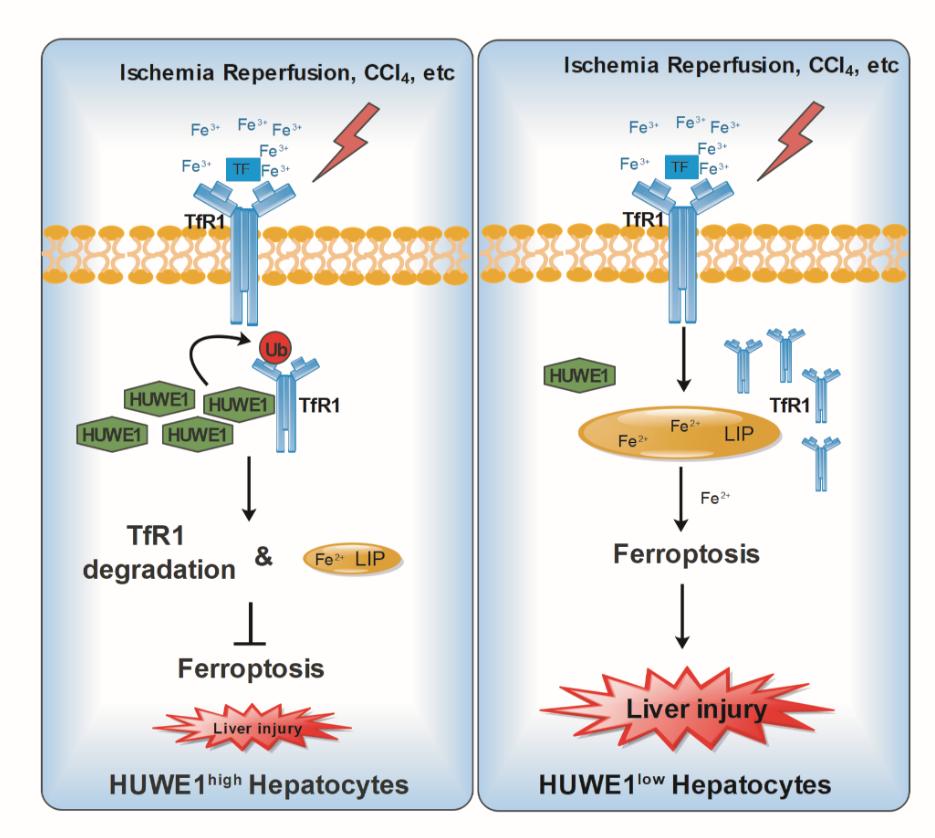
张晶课题组2019年成立以来,一直致力于研究氧化应激坏死包括铁死亡的分子机制以及对人类疾病的影响。在本研究中,研究人员通过分析仁济医院肝移植科夏强团队提供的肝移植临床样本,发现在肝移植之后泛素化连接酶E3 Huwe1/Mule在蛋白及mRNA水平出现了显著的下调,提示了Huwe1/Mule对肝移植的重要影响。为了明确Huwe1/Mule在肝脏缺血再灌注急性损伤过程中的作用,研究人员构建了Huwe1肝脏特异性敲除小鼠(Huwe1fl/fl;Alb-Cre)并建立小鼠肝脏缺血再灌注模型,检测了铁死亡的一系列相关指标,其结果证明了Huwe1/Mule的肝脏特异性敲除加剧了急性肝损伤中铁死亡的发生以及铁离子的沉积。同时,研究人员利用不同种类铁死亡诱导剂处理Huwe1/Mule的野生型和敲除的小鼠成纤维细胞和小鼠原代肝细胞,发现Huwe1的缺失确实能显著加剧铁死亡的发生。进一步地,通过免疫共沉淀联合质谱分析,研究人员鉴定了转铁蛋白受体家族蛋白TfR1是Huwe1/Mule的潜在下游底物。TfR1是铁代谢的关键调节因子,它是一种II型跨膜糖蛋白,通过受体介导的内吞作用(endocytosis)实现转铁-铁复合物的内化,从而为细胞提供铁。TfR1的化学和遗传抑制可显著减轻Huwe1/Mule敲除细胞和肝脏特异性敲除小鼠的铁死亡以及肝损伤。这些结果表明,Huwe1是一种新的肝脏缺血再灌注损伤的保护因子,通过Huwe1介导的TfR1泛素化和降解可显著抑制铁死亡。
欧洲杯竞猜平台2020级博士研究生吴妍和助理研究员焦慧科,岳扬波以及欧洲杯竞猜平台附属仁济医院何康博士为该论文的共同第一作者,欧洲杯竞猜平台张晶、钟清、岳扬波以及欧洲杯竞猜平台附属仁济医院夏强为该论文的共同通讯作者。

