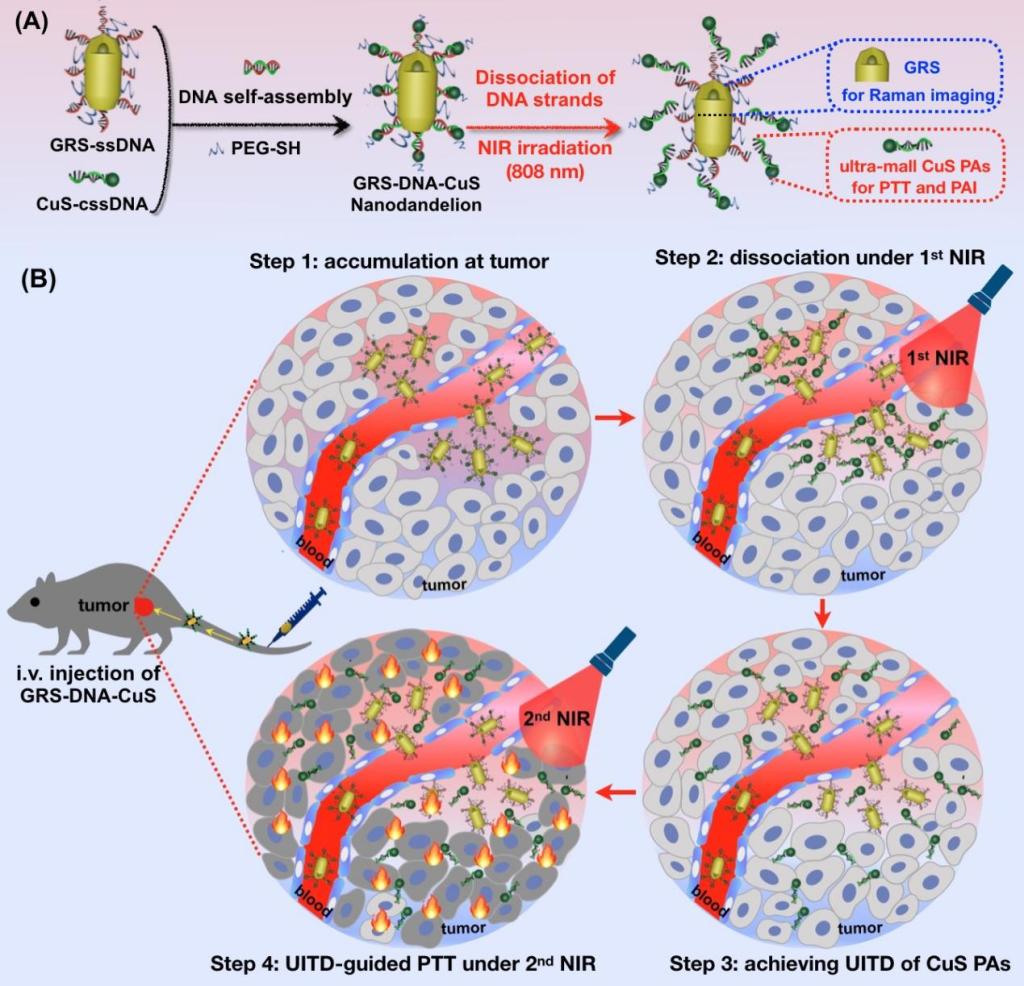
近日,基础欧洲杯竞猜平台肖泽宇教授课题组在生物材料领域知名期刊Biomaterials上发表了题为“DNA-assembled visible nanodandelions with explosive hydrogen-bond breakage achieving uniform intra-tumor distribution (UITD)-guided photothermal therapy”的研究成果。该研究基于DNA自组装技术构建了一种类似蒲公英结构的可视化纳米药物,命名为DNA自组装纳米蒲公英。此纳米蒲公英利用DNA双链中氢键的爆破式热解离特性,使光热试剂在肿瘤内由大粒径解离为小粒径,并可视化地监控其在肿瘤组织内时空均匀分散的过程,显著提高了光热治疗的疗效。

肿瘤光热疗法是将光热试剂聚集在肿瘤组织,并利用近红外光(NIR)照射触发,将光能转化为热能来杀死癌细胞的一种治疗方法。由于具有较深的组织穿透性、较高的空间选择性和较低的系统毒性等优势,已成为最具临床应用前景的局部热消融肿瘤的方法。然而,光热疗法的瓶颈在于,光热试剂难以在肿瘤内均匀分布,以致只有光热试剂富集处的癌细胞会被较高的光热温度杀伤,而没有光热试剂富集的癌细胞由于局部温度较低仍然存活,导致疗效受限。
针对这一重要医学问题,研究者受到风吹蒲公英后种子散落的启发,制备了一种类蒲公英结构的DNA自组装可视化纳米药物,命名为DNA自组装纳米蒲公英(GRS-DNA-CuS)。此纳米蒲公英是由DNA双链(如同蒲公英的花柱)将内核拉曼影像探针GRS(如同蒲公英的花托)和外壳超小CuS光热试剂(如同蒲公英的种子)自组装于一体。由于纳米蒲公英GRS-DNA-CuS具有较高的光热转化效应,在第一次NIR辐照后,能够迅速达到DNA的解链温度,导致氢键爆破式断裂,使得富集到肿瘤处的大粒径纳米蒲公英GRS-DNA-CuS(~135 nm)完全、彻底地解离成两部分:GRS和超小CuS光热试剂(~12nm)。由于肿瘤局部超小CuS光热试剂的浓度迅速增加,促使其在肿瘤组织内具有较强的扩散能力,6小时即可在肿瘤内均匀扩散开,犹如风吹打蒲公英后种子四处飘散。随后,已经完成瘤内均匀分布的超小CuS光热试剂,在第二次NIR辐照下,达到光热消融所有癌细胞,高效根除肿瘤的目标。与此同时,具有较好空间分辨率的拉曼成像和较强组织穿透性的光声成像技术,为两次近红外光辐照提供了精准的光照时间和空间位置,以可视化的方式监控了光热试剂在肿瘤处富集、解离、扩散和光热治疗的整个过程,显著提升了光热治疗的疗效。总之,我们提出可视化监控光热试剂在瘤内均匀分散的理念,为光热高效治疗肿瘤提供了新的研究思路。
欧洲杯竞猜平台基础欧洲杯竞猜平台博士生张永明,助理研究员崔彦娜和硕士生李明旺为该论文的共同第一作者。肖泽宇教授为该论文的通讯作者。该研究获得国家重点研发计划、国家自然科学基金国际(地区)合作项目等资助。

