表观遗传药物可直接杀伤肿瘤细胞,同时启动先天和适应性抗肿瘤免疫反应,但目前主要应用于血液肿瘤的治疗,而对于实体瘤的疗效有限,其瓶颈问题在于表观遗传药物会诱导髓源性抑制细胞(MDSCs)的分化和肿瘤浸润,所形成的免疫抑制微环境大大削弱了药物功效。基于此,欧洲杯竞猜平台公共卫生学院宋海云研究员团队和上海师范大学化学与材料科学院陈楠教授团队设计了一种ATP响应型连体纳米粒子(Siamese nanoparticles, SIANP),可以协同性地提高肿瘤靶向性和特异性地在肿瘤微环境中解离,分别向肿瘤细胞和MDSCs递送不同的抗肿瘤药物:利用组蛋白甲基转移酶抑制剂CM-272诱导肿瘤细胞的免疫原性死亡;利用布鲁顿酪氨酸激酶抑制剂Ibrutinib阻遏MDSCs的瘤内富集。通过肿瘤微环境的重塑,抑制肿瘤生长,并进一步克服肿瘤对免疫检查点阻断治疗的耐药性。该研究发展了一种精准、高效的药物共递送纳米平台,为增强表观遗传疗法在实体肿瘤中的治疗功效提供了新思路。相关工作近期以“Unzippable Siamese Nanoparticles for Programmed Two-Stage Cancer Immunotherapy”为题发表在高影响力学术期刊Advanced Materials。

本研究中,研究人员先分别设计了靶向肿瘤细胞的纳米粒子用于负载CM-272和靶向MDSCs的纳米粒子用于负载Ibrutinib。两种纳米粒子通过表面修饰的DNA单链基于碱基互补反应进行非共价键连接。其中一种DNA单链中包含了ATP适配体序列,能够在高浓度ATP的竞争性作用下实现双链解离。由于肿瘤组织的细胞外ATP浓度比正常器官的细胞外ATP浓度高3~4个数量级,SIANP能够特异性地在肿瘤微环境中快速解离成两种纳米粒子,而在血液和正常器官中保持连体状态。该设计能够同时借助两种纳米粒子的靶向功能,与共递送两种游离药物或者同时递送两种非连体的纳米粒子相比,SIANP可达到更高效、精准的药物递送效率(图1)。
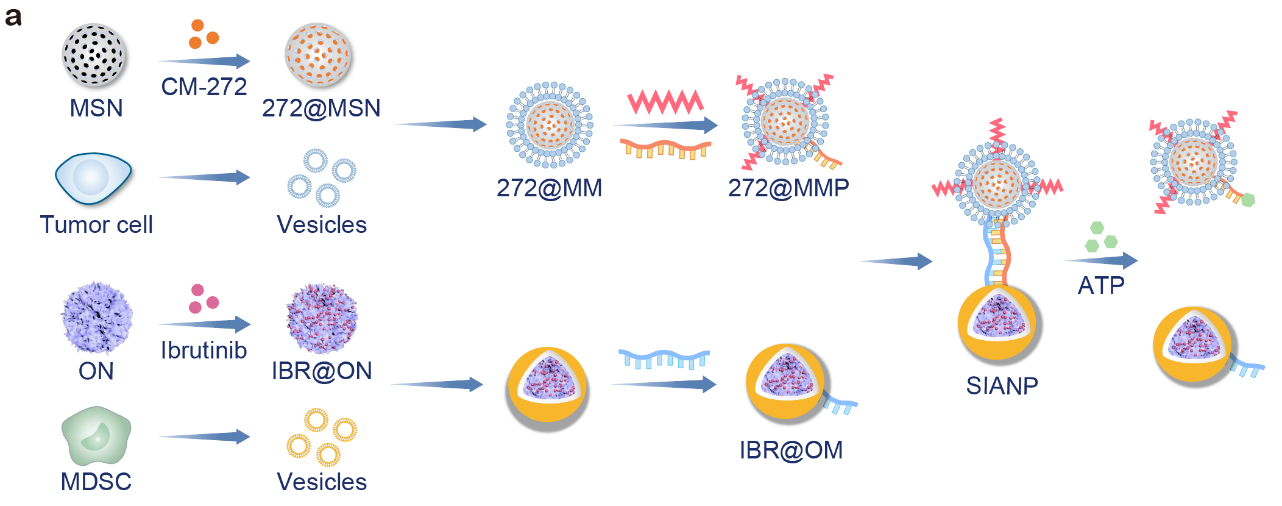
图1. SIANP的制备过程示意图。图片来源:Adv. Mater.
在肿瘤微环境中,SIANP响应ATP解离,分别靶向肿瘤细胞和MDSCs。进入肿瘤细胞的纳米粒子释放CM-272,通过表观遗传调控诱导内源性逆转录病毒(ERV)表达和免疫原性细胞死亡(ICD),激活先天和适应性免疫反应;另一方面,进入MDSCs的纳米粒子释放Ibrutinib,通过重编程使MDSCs失去免疫抑制细胞的特征和功能。在三阴性乳腺癌和结肠癌小鼠模型中,SIANP可防止CM-272诱导的MDSCs在肿瘤内富集,协同促进肿瘤浸润树突状细胞成熟、CD8+ T细胞募集和激活,并抑制肿瘤生长(图2)。此外, SIANP与免疫检查点抑制剂联合治疗,能够克服三阴性乳腺癌对免疫检查点阻断疗法的耐药性。
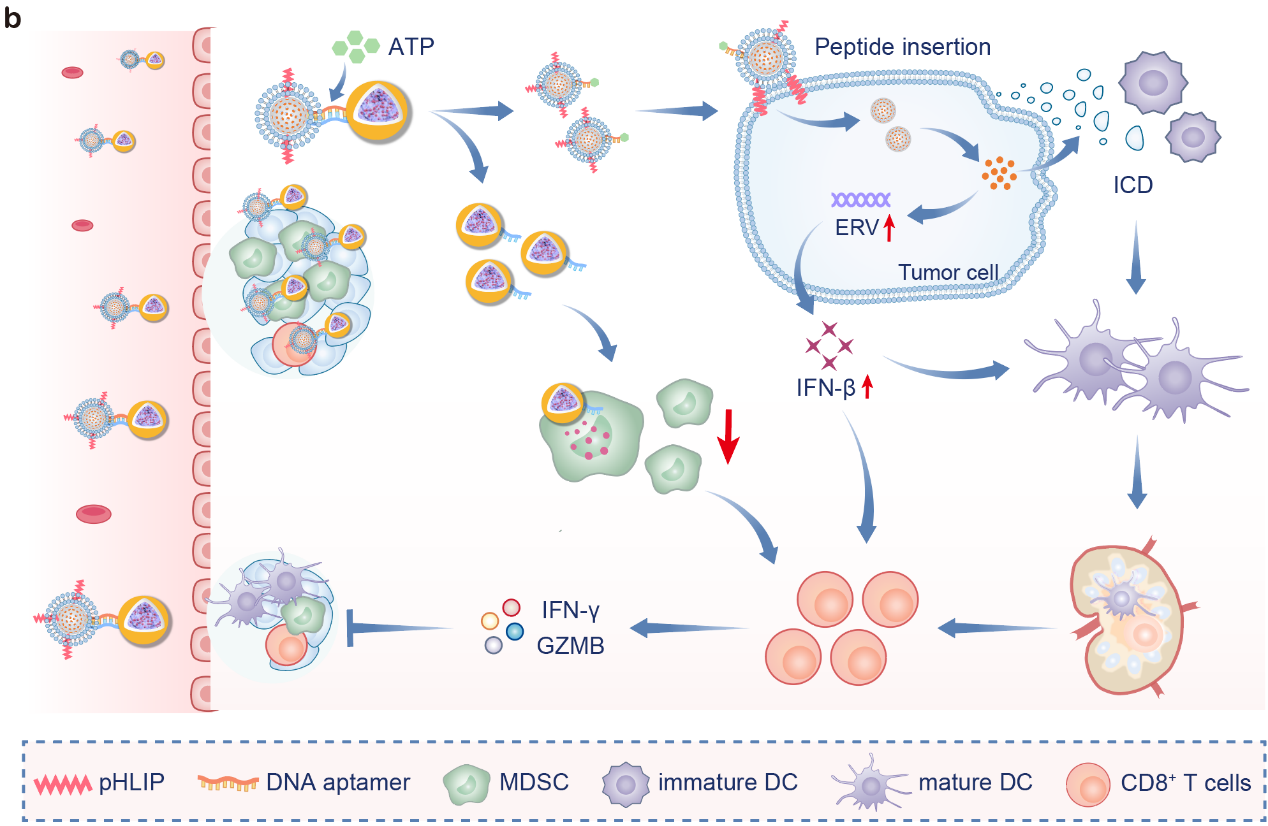
图2. SIANP的抗肿瘤机制。图片来源:Adv. Mater.
欧洲杯竞猜平台公共卫生学院宋海云研究员和上海师范大学化学与材料科学院陈楠教授为该文的共同通讯作者。欧洲杯竞猜平台博士研究生隆梅和副研究员周炎烽为该论文的并列第一作者。

