9月17日,欧洲杯竞猜平台公共卫生学院王慧/李晓光团队在Cell子刊Cell Reports Medicine上发表原创论文“Dietary vitamin B3 supplementation induces the antitumor immunity against liver cancer via biased GPR109A signaling in myeloid cell”。该研究发现膳食维生素B3(VB3)补充通过激活髓系细胞内GPR109A/β-Arrestin信号通路促进抗肿瘤免疫,有效防治肝癌。

膳食成分在营养素的可利用性方面扮演着重要角色,直接影响癌细胞和免疫细胞的行为和功能。营养素包括蛋白质、碳水化合物、脂肪酸、维生素和矿物质等。研究表明,饮食中的营养素能够调节机体免疫稳态,影响癌症的进展和预后。肿瘤患者通过饮食模式改变肿瘤微环境中的营养供应成为抑制肿瘤生长的有效策略。因此,癌症患者如何选择和使用膳食补充剂发挥辅助癌症治疗的作用,其临床效果及潜在机制研究成为当下关注热点。
王慧和李晓光联合团队前期在国际消化系统顶级期刊GUT在线发表了题为:Glutamine metabolic competition drives immunosuppressive reprogramming of intratumour GPR109A+myeloid cells to promote liver cancer progression的研究论文(原文链接:https://gut.bmj.com/content/early/2024/07/09/gutjnl-2024-332429),发现肿瘤微环境中肝癌细胞和髓系细胞之间存在营养竞争:肝癌细胞通过掠夺谷氨酰胺,驱动髓系细胞发生营养应激和代谢重编程,进而诱导GPR109A+免疫抑制性髓系细胞介导的免疫逃逸和治疗抵抗,揭示GPR109A可作为关键的营养-免疫代谢检查点和潜在肝癌免疫治疗靶点(Gut杂志同期发表专题评论“The Q for immune evasion in HCC: ER stress in myeloid cells”)。有趣的是,维生素VB3(VB3)作为GPR109A内源性配体,其是否在调节肝癌免疫代谢和改善治疗效果等方面发挥作用尚不清楚。

针对上述科学问题,王慧和李晓光联合团队成员杨阳等通过综合运用多个人群队列公共数据库、肿瘤生物信息数据库和多种肝癌动物模型等研究策略,揭示了膳食中的VB3如何通过重塑免疫抑制性肝癌肿瘤微环境来诱导抗肿瘤免疫反应的发生。具体来说,在人群研究中发现,与其他B族维生素相比,较高的VB3摄入显著降低肝癌的发生风险并改善肿瘤患者预后;在多种肝癌小鼠模型中,VB3均显示良好抗肿瘤效果,并增敏肝癌免疫治疗或靶向治疗疗效。机制研究发现,VB3通过打破肿瘤相关髓系细胞介导的免疫抑制肿瘤微环境,激活CD8+ T细胞的肿瘤杀伤功能,重塑抗肿瘤免疫微环境。进一步研究表明,肝癌肿瘤微环境中髓系细胞内GPR109A/NF-κB的异常激活,正反馈促进免疫抑制性肿瘤微环境的形成;而VB3通过促进β-Arrestin介导的GPR109A受体降解及抑制下游NF-κB信号轴的异常激活,解除髓系细胞的免疫抑制性极化,从而进一步激活CD8+ T细胞的免疫杀伤功能(图1)。
综上,该研究发现VB3在肿瘤微环境中的免疫调节活性,表明膳食补充VB3可以增强抗肿瘤免疫反应提高肝癌免疫治疗和靶向治疗的疗效。此外,研究还证明GPR109A可作为VB3精准防治肝癌的潜在生物标志物,为肝癌的精准营养干预和辅助治疗提供了重要的理论依据和临床转化价值。
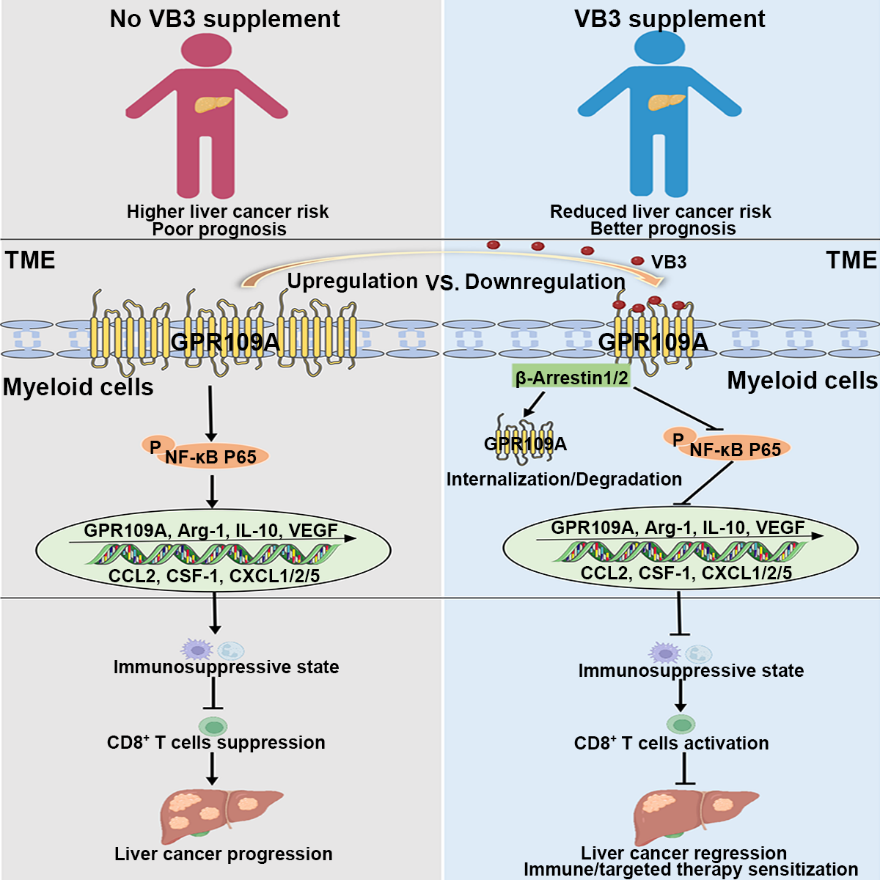
图1 VB3促进抗肿瘤免疫发生防治肝癌的机制示意图
欧洲杯竞猜平台公共卫生学院助理研究员杨阳、实验师胡小林、研究生裴天铎和卢雨为该文的第一作者,王慧教授、李晓光研究员和巴乾研究员为该论文的通讯作者。该研究得到了国家重点研发计划、基金委重点项目、上海市自然科学基金、上海市教委创新团队等项目的支持。

