8月25号,国际学术期刊《Immunity》(IF:21.56)在线发表了健康科学研究所钱友存研究组与沈南研究组的合作研究论文“Growth
Factor FGF2 Cooperates with Interleukin-17 to Repair Intestinal
Epithelial Damage”。该研究发现,在肠炎的发病过程中,宿主肠道固有层的调节性T细胞(Treg cells)和辅助性T
细胞17(Th17
cells)会针对紊乱的肠道菌群做出响应并分别分泌具有保护作用的生长因子FGF2和白介素17来协同修复肠道上皮层所受的损伤从而维持肠道粘膜系统的免疫稳态。
宿主的肠道系统存在着数量惊人的微生物,这些肠道中的微生物群落被统称为肠道菌群(intestinal
microbiota)。经过漫长的共同进化,肠道为这些微生物提供天然的栖息之地和适宜的生长环境。同时,肠道菌群能够发挥维持宿主自身的消化吸收,能量代谢以及免疫系统的成熟发育等功能。这种互惠共生关系的和谐存在维持了宿主的肠道稳态乃至个体的健康。宿主的肠道上皮层不仅对于机体抵御外来病原菌的入侵至关重要,还对于自身菌群共生关系的维持十分关键。当肠道上皮层受到损伤且没有被正确修复时,这些原本共生的肠道菌群会发生失调和紊乱,并通过宿主的先天免疫信号通路如Toll样受体(toll
like receptor,TLR)通路来启动宿主的肠道炎症反应,继而导致或加速肠道炎症疾病如炎症性肠病(inflammatory
bowel disease, IBD)和结肠癌(colorectal
cancer,CRC)的发生发展。为了避免肠道炎症反应的过度激活,肠道粘膜免疫系统也会迅速做出响应并力图修复受损的肠道上皮层从而使得肠道稳态得以重建。这一过程一般由多种胞外因子(如细胞因子和生长因子等)参与完成,但这些因子之间的合作网络仍有待阐明。白介素17(IL-17)家族细胞因子是一类新近被发现的细胞因子类群,越来越多的研究发现该家族成员与炎症的发生有着密切的联系。其代表性成员IL-17A(也称IL-17)作为该家族中研究最为深入的成员,已经被认为参与了机体的多种炎症反应和疾病发展。自IL-17A首次发现以来,人们已经发现了六个IL-17家族细胞因子,分别为IL-17A至F。其受体家族具有五个成员,分别为IL-17RA至RE。2011年至今,钱友存实验室系统地研究了该家族细胞因子在肠道粘膜免疫中的功能,并分别在《Nature
Immunology》(2011)和《Immunity》(2014)上发表论文阐明该家族新成员白介素17C在多种肠道免疫疾病中的作用机制。
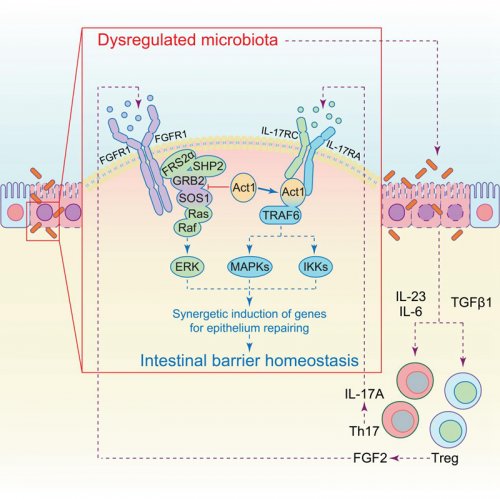
为了进一步解析肠道粘膜免疫反应中复杂的信号网络和肠道菌群免疫稳态之间的调控关系,宋昕阳博士和博士研究生戴黛合作利用IL-17A和FGF2基因缺陷小鼠建立的肠道炎症模型,多种免疫学分析手段和16SrRNA基因测序技术等方法发现紊乱的肠道菌群除了会导致肠道的炎症反应以外,也会促使机体诱导Treg和Th17细胞分别产生FGF2和IL-17来协同诱导肠道上皮层中损伤修复相关基因的表达从而使得失调的肠道菌群和粘膜炎症反应回归稳态。FGF2或IL-17A基因的缺失将导致肠道上皮修复的减慢和致炎性肠道菌群的不可控增殖继而导致更严重的肠炎病理。研究还首次发现失调的肠道菌群可以诱导TGFβ1在肠道中的表达,从而诱导肠道Treg细胞特异性产生FGF2来促进其免疫调节功能。从分子机制上来说,研究人员首次发现IL-17信号通路下游重要的接头蛋白Act1通过与SOS1竞争结合GRB2来抑制FGF2的ERK信号通路的激活,但当IL-17和FGF2信号同时存在时(比如肠炎发生的情况下),Act1会优先结合到IL-17受体复合物上,使得其对FGF2下游ERK信号通路的抑制得以解除,由此放大了这两个因子所介导信号的下游生物学效应。该研究不仅发现了机体维持肠道菌群免疫稳态的新机制,也对于解析肠炎相关疾病的致病机理有重要的理论与临床意义。
该课题受到国家自然科学基金委,国家科技部,中国科学院和上海市科委的经费支持。

