11月2日,国际高端生命科学杂志eLIFE在线发表了欧洲杯竞猜平台基础欧洲杯竞猜平台徐天乐教授研究组题为“Tissue acidosis
induces neuronal necroptosis via ASIC1a channel independent of its
ionic
conduction”的新成果,该研究揭示缺血性脑卒中分子病理新机制,并且鉴定了介导缺血性神经细胞死亡的关键信号分子,为指导脑卒中防治提供了新线索和实验依据。
缺血性脑卒中是一种高发性,高致残和高致死性疾病。然而,目前治疗缺血性脑卒中的有效药物极为稀缺,美国食品药品管理局(FDA)仅仅批准了一种溶栓药物t-PA用于临床治疗。即便如此,t-PA依然具有治疗有效时间窗短,易引起继发性脑出血等诸多应用局限性。因此,研究致病机理并鉴定由缺血引起的神经细胞死亡的关键信号分子,就成为了脑卒中相关研究的重中之重。
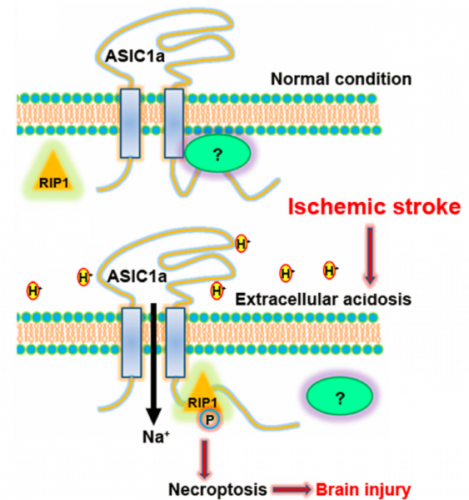
徐天乐教授研究组以往的研究支持酸敏感离子通道1a(ASIC1a)是缺血性脑卒中治疗的新型分子靶点(Neuron, 2005; J
Neurosci, 2011; 2013; Cell Death Differ,
2013)。然而ASIC1a通道介导缺血性神经细胞损伤的下游信号分子始终不清,严重妨碍了其作为脑卒中治疗药物靶点的开发研究。此项新研究发现,缺血致氧气和葡萄糖缺失,进而引起脑组织酸化,导致作为ASIC1a通道的配体——质子的浓度持续升高,一方面激活ASIC1a通道并促使其脱敏;另一方面在质子配体的作用下,ASIC1a蛋白与一种重要的细胞内死亡诱发激酶RIP1特异性结合,引发后者的磷酸化,进而激活神经细胞程序性坏死(necroptosis)进程,导致脑组织坏死。特异性抑制RIP1的磷酸化或者敲减RIP1的蛋白表达,都可以高效的抑制神经元程序性坏死。有趣的是,在这一重要病理过程中,身为离子通道的ASIC1a却“不务正业”,与RIP1的结合以及RIP1磷酸化都与其“本职工作”--离子流通功能无关。这一新发现颠覆了缺血过程中细胞钙离子超载致死的传统认识,为基于ASIC1a通道的脑卒中治疗药物研究提供了全新的理论指导。鉴于多发性硬化症,亨廷顿氏症等神经退行性疾病也伴有明显的神经组织酸化,该新发现对包括这些疾病在内的其它神经系统疾病防治的广泛指导意义有待进一步研究。
这项工作由欧洲杯竞猜平台博士后王宜之和博士研究生王晶晶作为共同第一作者完成,研究工作得到了国家科技部、自然基金委和中国博士后基金等支持。同时还得到了美国University
of Texas的朱曦教授和Morehouse School of Medicine的熊志刚教授的合作支持。
原文链接:http://elifesciences.org/content/elife/4/e05682.full.pdf
徐天乐研究组链接:http://bmf.shsmu.edu.cn/xulab/

