10月10日,国际知名学术期刊《自然-方法(Nature Methods)》在线发表了中国科学院上海生命科学研究院/欧洲杯竞猜平台健康科学研究所常兴研究组题为“Targeted AID -mediated mutagenesis (TAM) enablesefficient genomic diversification in mammalian cells”的最新研究成果,报道了利用靶向性胞嘧啶脱氨酶在体内实现高效率和高通量的DNA碱基编辑的新方法。
单核苷酸的多样性是遗传多样性的主要来源,是分子进化的动力和很多疾病的直接诱因。然而由于哺乳动物基因组的高度稳定性,在哺乳动物细胞内很难高效和高通量地诱导单核苷酸的突变,进而研究这些突变的功能。虽然通过CRISPR等基因编辑技术,可以实现较高效的DNA切割和基因敲除,但由于同源重组(HDR)的效率低下,现有的CRISPR技术对于体内构建单核苷酸突变仍处于低效阶段。
靶向性AID介导的核苷酸突变(TAM)这种新的研究方法,有可能改变这一现状。有别于绝大多数体细胞基因组,适应性免疫系统在淋巴细胞发育过程中可以进行高效编辑,对抗原受体进行高效突变,产生近乎无限的抗原受体库,用以抵御可能的病原体入侵。受这一“突变自我”机制的启发,博士研究生马云青和张佳元在常兴研究员的指导下发现,当把核酸酶缺陷的Cas9蛋白和诱导抗体高频突变的胞嘧啶脱氨酶AID融合后,在sgRNA靶向的基因组DNA上,胞嘧啶和鸟嘌呤可以随机地向其它三个碱基转变。这一新方法可以对细胞内的特定DNA序列进行多样化,完成遗传筛选,从而分析单核苷酸突变的功能。同时在一种多肽抑制剂的辅助下,dCas9-AID可以诱导特定的胞嘧啶向胸腺嘧啶转变,实现单碱基的精确编辑。该研究团队进一步证明,利用这一方法可以快速有效地模拟肿瘤细胞体内耐药机制的异质性,预测可能的肿瘤耐药性突变,进而改良小分子抑制剂和研究小分子与蛋白质靶点的相互作用。该研究成果为分子进化、基因治疗和在单碱基水平上分析基因调控元件等领域提供新的方法。
该工作得到了科技部、国家自然科学基金委、和上海市科委的相关资助。
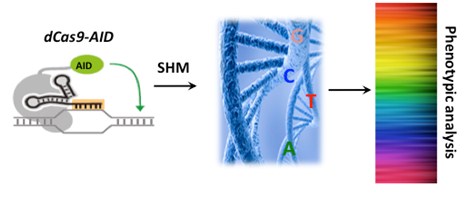
dCas9-AID融合蛋白,被sgRNA招募到相应的基因组DNA上,随机诱导胞嘧啶和鸟嘌呤的点突变,从而实现体内特定DNA序列的多样化,通过遗传筛选,高通量分析单核苷酸突变的功能。

