2020年7月15日,欧洲杯竞猜平台上海市免疫学研究所李斌课题组在Science Bulletin上发表了题为"Single-cell RNA-seq unveils critical regulators of humanFOXP3+ regulatory T cell stability”的论文,应用单细胞技术,揭示了炎症环境下Treg细胞异质性,发现并验证了CYP1A1是Treg细胞功能和稳定性的调控因子。

CD4+CD25+Treg细胞对于机体免疫稳态来说必不可少。转录因子forkhead-box-P3(FOXP3)在Treg细胞中特异性表达,其在维持Treg免疫抑制特性中起着至关重要的作用。FOXP3控制着一系列的免疫调节基因,从而使Treg细胞有别于CD4+FOXP3−效应性T细胞。Treg细胞在细胞因子和抗原攻击后表现出不稳定性和可塑性。李斌课题组近年来结合分子生化实验、单细胞高通量测序和生物信息学分析等技术手段,致力于解析Treg细胞中FOXP3蛋白质翻译后修饰和分子机制。
最近的研究表明,Treg细胞中存在着异质性,在特定的信号诱导炎性效应基因表达时,Treg细胞的免疫抑制能力可能降低。TIGIT作为一种共抑制分子在Treg细胞中高度表达,并可直接抑制T细胞的活化和增殖。TIGIT高表达的Treg细胞可能定义了功能性激活的Treg细胞子集。在炎性组织中升高的IL-6可降低Treg细胞的抑制能力并促进产生IL-17的Th17细胞的分化。虽然对Treg细胞的异质性和可塑性的研究越来越多,但是,炎症和Treg异质性之间的关系仍然知之甚少。
单细胞测序技术的出现为深入了解揭示Treg细胞群体内的异质性开辟了道路,并可借此方法在单细胞水平上探究Treg亚型如何对炎性细胞因子刺激做出反应。通过单细胞测序,最近有报道称TCR信号传导可影响Treg分化和功能稳定性。单细胞转录组分析已应用于多个研究领域,包括肿瘤免疫,免疫细胞发育,树突状细胞双峰性和造血功能。单细胞转录组分析还可以进一步了解免疫细胞功能的潜在调节因子。
李斌课题组定义了促炎细胞因子IL-6治疗后Treg群体的表型和功能异质性。课题组研究发现IL-6刺激后的Treg细胞的分成两个亚群。不稳定的Treg亚群降低了FOXP3和Treg相关标志物的表达,增加了TNF-α和IL17A的表达,并且糖酵解和增殖都升高了。而相对稳定的Treg细胞亚群显示出了更高的Treg相关标志物表达。此研究结果表示,部分Treg细胞可以解除免疫抑制功能,从而获得效应性T细胞的部分特性。稳定的Treg细胞对炎症信号敏感,可以浸入炎症组织中,以防止在IL-6存在下过度炎症损伤。此外,本研究还发现并验证了CYP1A1是Treg细胞功能和稳定性的新调节剂。敲低CYP1A1的表达会显著影响Treg细胞的免疫抑制能力,并增加炎症细胞因子的表达。因此,该研究还提示了CYP1A1可能是调节炎症微环境下Treg细胞稳定性功能的新型治疗靶点。
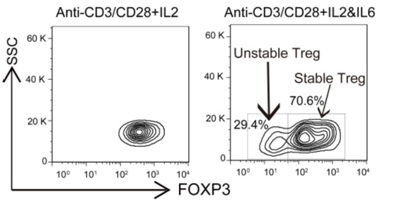
图1. 在IL-6刺激的情况下FOXP3的表达;根据FOXP3表达水平,Treg细胞可分为两个子集:“不稳定”和“稳定”状态。
李斌研究员为论文通讯作者,博士后赵毅和研究生伊刚、解丰为共同第一作者。该工作得到了国家自然科学基金委项目等资助。
李斌研究员及课题组简介:
李斌研究员,余㵑学者、上海交大特聘教授、国家基金委免疫学杰青、上海市领军人才、上海市优秀学科带头人,上海市免疫学研究所科研副所长和课题组长;中国细胞生物学学会科学普及工作委员会主任委员和免疫细胞生物学分会副会长、欧美同学会上海生物医药分会副会长;Science Bulletin副主编 (2018)、European Journal of Immunology 执行委员会成员(2020)、Cellular & MolecularImmunology编委 (2018)、 Scientific Reports 编委 (2018)。
李斌博士长期从事调节性T细胞相关基础研究,近年来在炎症条件下Treg细胞功能稳定性,T细胞分化关键转录因子和广谱宿主因子的翻译后修饰及其相关酶类的活性调节等方面取得了突出成绩。2009年回国以来,在国际学术刊物如Immunity,PNAS,Nat Commun,J Biol Chem,J Immunol,J Virol,PLOS Pathogens ,EMBO Rep等发表通讯及共同通讯作者60余篇。承担国家基金委杰出青年基金、重点项目(2项) 、中美及中波国际合作项目等。
撰稿:赵毅
编辑:冯昫皎
审核:李斌 方丽娟
 沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@sjtu.edu.cn
沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@sjtu.edu.cn