邹强课题组等在JEM发表论文揭示Treg细胞代谢与免疫耐受的空间调控机制
发布日期:2018-08-29

2018年8月16日,Journal of Experimental Medicine (JEM)发表了欧洲杯竞猜平台上海市免疫学研究所邹强课题组等的研究论文,论文题目为“Metabolic control of regulatory T cell stability and function by TRAF3IP3 at the lysosome”。本项研究发现定位在溶酶体膜上的跨膜分子TRAF3IP3抑制调节性T细胞内部mTORC1活性及其介导的糖酵解水平,从而维持调节性T细胞稳定与功能,进而促进肿瘤免疫耐受的建立。本研究不仅阐述了调节性T细胞内部溶酶体膜水平的分子调控机制,而且为开发新的肿瘤治疗靶点奠定理论基础。
调节性T细胞(Treg)是一类具有免疫抑制功能的T细胞亚群,一方面维持机体的免疫平衡,另一方面促进肿瘤免疫耐受的建立,一旦其功能发生异常,将导致自身免疫病、肿瘤等疾病发生。细胞代谢控制调节性T细胞发育、分化和功能,代谢水平紊乱将引起调节性T细胞功能异常。调节性T细胞主要依赖氧化磷酸化维持其扩增、存活及功能,而过强的糖酵解水平导致调节性T细胞稳定性与免疫抑制功能减弱。近几年的热点研究证明mTOR信号通路调控调节性T细胞内部的糖代谢,然而mTORC1与mTORC2如何在调节性T细胞中分工协作及其时空调控机制依然不清楚。
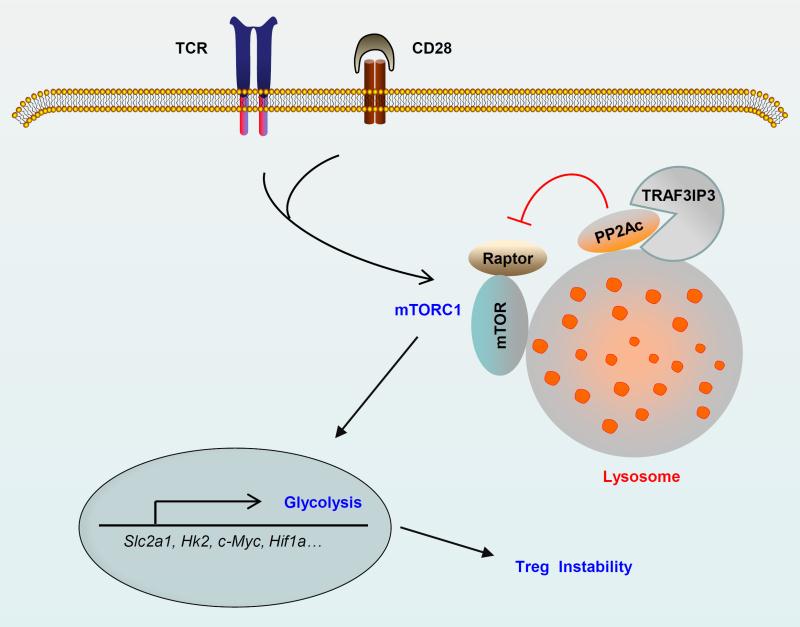
围绕这一重要科学问题,上海市免疫学研究所邹强课题组与美国MD安德森癌症中心Shao-Cong Sun、上海市免疫学研究所刘智多和路丽明课题组密切合作,发现T细胞受体(TCR)信号诱导调节性T细胞中mTORC1复合体在溶酶体膜上的组装与激活,而定位在溶酶体膜上的跨膜分子TRAF3IP3特异性招募磷酸酶PP2A的催化亚基并促进其与mTORC1复合体中的Raptor分子结合,从而抑制mTORC1活性及其介导的糖酵解水平并维持调节性T细胞稳定与功能;靶向TRAF3IP3可以有效打破调节性T细胞介导的肿瘤免疫耐受机制,增强T细胞杀伤肿瘤细胞的功能;干预TRAF3IP3活性能有效增强PD-1抗体治疗肿瘤的效果。这项研究不仅揭示了调节性T细胞内部mTORC1信号通路的空间调控机制,而且首次阐述了TRAF3IP3介导糖代谢与免疫耐受的溶酶体调控机制,为发掘潜在的肿瘤免疫治疗靶点奠定基础。
欧洲杯竞猜平台助理研究员于晓彦博士、实验师滕晓鹿博士、博士生王飞翔和博士后郑钰涵博士是本论文的共同第一作者,邹强研究员、Shao-Cong Sun教授、刘智多研究员与路丽明研究员为共同通讯作者。该研究得到了上海市免疫学研究所苏冰教授、陈磊研究员、李华兵研究员等的大力支持,并受到国家海外青年高层次人才计划、国家重点研发计划、国家自然科学基金面上项目、上海市科委启明星计划及上海市卫计委优青项目等资助。
原文链接:http://jem.rupress.org/content/early/2018/08/14/jem.20180397
通讯作者简介
邹强研究员2012年博士毕业于中国农业大学,2012年-2016年在美国MD安德森癌症中心从事博士后工作,2016年3月任职于上海交大欧洲杯竞猜平台上海市免疫学研究所。课题组主要研究蛋白质翻译后修饰调控肿瘤免疫与T细胞免疫的分子机制,聚焦肿瘤免疫代谢调控与肿瘤免疫耐受,系列研究成果先后以通讯作者身份在Nature Communications (2018), Journal of Experimental Medicine (2018) 等杂志发表。邹强研究员先后获得国家海外青年高层次人才计划、国家自然科学基金面上项目、上海市青年科技启明星计划、上海市卫计委优秀青年医学人才项目等资助。
 沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@sjtu.edu.cn
沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@sjtu.edu.cn