2021年12月7日,Journal of Clinical Investigation杂志在线发表了军事科学院军事医学研究院、国家蛋白质科学中心(凤凰中心)唐丽/贺福初团队联合欧洲杯竞猜平台上海市免疫学研究所王静团队的合作成果 “ALK1 signaling is required for the homeostasis of Kupffer cells and prevention of bacterial infection”。该研究揭示了TGF-β超家族成员BMP9&BMP10—ALK1—Smad4信号轴在维持肝脏定居巨噬细胞(Kupffer细胞)组织特异性命运和功能中的决定性作用,明确了肝脏微环境指导肝脏定居巨噬细胞获得自我更新和免疫防御功能的分子机制。

肝脏定居的Kupffer细胞作为丰度最高的组织定居巨噬细胞,其所处的组织微环境使Kupffer细胞获得了独特的基因表达及功能,在捕获循环细菌、控制全身性细菌感染中发挥至关重要的作用。然而肝脏组织微环境调控Kupffer细胞稳态和功能的分子机制尚不明确。
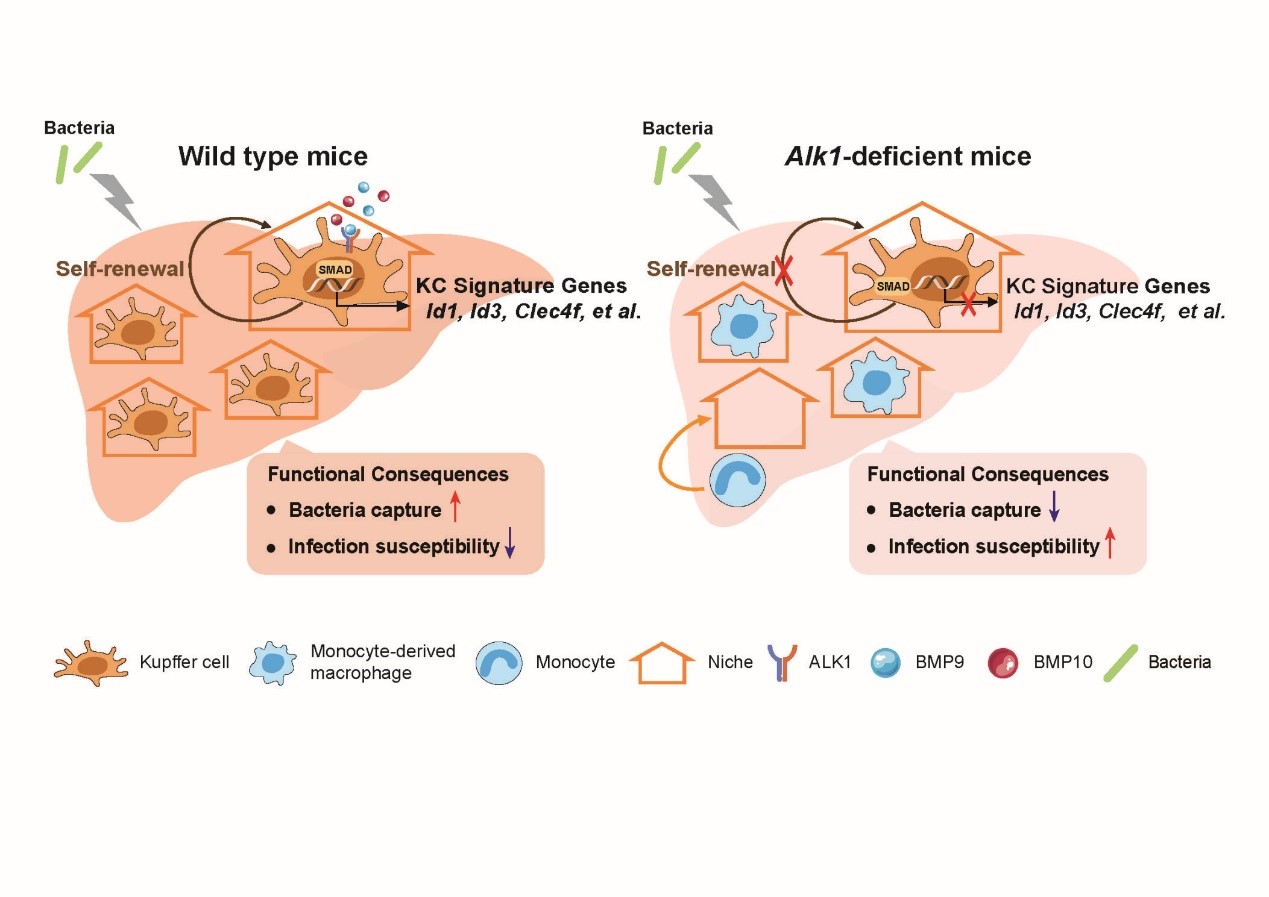
在该研究中,唐丽/贺福初团队的研究人员发现肝脏微环境中信号分子BMP9&BMP10通过巨噬细胞表面受体ALK1及胞内转录调节因子Smad4特异性调控肝脏巨噬细胞的命运决定,ALK1的敲除使肝脏巨噬细胞不能分化为成熟的Kupffer细胞,失去自我更新能力并不断丢失,需要外周单核细胞的补充。
为进一步解析ALK1信号缺失后Kupffer细胞稳态调节失衡对Kupffer细胞具体功能的影响,唐丽/贺福初团队与上海市免疫学研究所王静团队展开通力合作。通过免疫荧光和对巨噬细胞的形态学分析,研究人员发现ALK1缺失后Kupffer细胞失去原本富集于门静脉的不对称空间分布,细胞体积和表面积均显著下降,并且显著下调了捕获革兰氏阳性菌的主要受体VSIG4。这提示Kupffer细胞丧失了有利于其高效捕获病原体的空间分布,形态特征和膜表面受体表达,可能严重损害了其抵御感染的能力。研究人员进一步利用肝脏活体成像技术直接观察小鼠全身性细菌感染模型中Kupffer细胞捕获细菌的动态过程,结果表明ALK1缺失的小鼠肝脏Kupffer细胞严重缺乏捕获循环细菌的能力,最终导致小鼠感染后的死亡。这些发现阐明了BMP9&BMP10—ALK1—Smad4信号通路作为肝脏定居巨噬细胞稳态和功能维持的分子机制,对巨噬细胞的免疫防御功能至关重要,为病理状态下肝脏定居巨噬细胞稳态失衡造成的全身性细菌感染提供潜在的治疗思路。
军事科学院军事医学研究院、国家蛋白质科学中心(凤凰中心)唐丽研究员和贺福初院士、欧洲杯竞猜平台上海市免疫学研究所王静研究员为论文共同通讯作者,上海市免疫学研究所博士生王阳为论文共同第一作者。上海市免疫学研究所显微成像平台为成像实验提供技术支持。
论文链接:
https://www.jci.org/articles/view/150489
撰文: 王阳
 沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@sjtu.edu.cn
沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@sjtu.edu.cn