“癌-胚”重编程(Onco-fetal reprogramming)是指在肿瘤发展过程中肿瘤微环境中的某些细胞类群可以表现出与胎儿发育时类似的特征和功能。2020年, 澳大利亚科廷大学Ankur Sharma教授在Cell上发文[1],首次证明了肝细胞癌(HCC)的肿瘤微环境表现出了与胎肝发育过程相似的免疫抑制特征,包括胎儿相关PLVAP+内皮细胞(EC)和胚胎样FOLR2+肿瘤相关巨噬细胞(TAM)的出现,并证明了“癌-胚”细胞群与Treg细胞间存在共定位关系。为了进一步探究“癌-胚”重编程过程中的细胞作用机制及功能,本项研究系统性地描绘了HCC肿瘤相关成纤维细胞(CAF)图谱及胎肝成纤维细胞图谱,并从中鉴定出了具有“癌-胚”特征的CAF细胞。研究人员进一步对“癌-胚”细胞类群间的细胞通讯关系进行了生物信息学分析,并利用空间转录组学对“癌-胚”细胞类群的空间共定位进行了验证,最终揭示了“癌-胚”重编程过程与肿瘤复发及免疫治疗响应情况之间的关系(图1)。
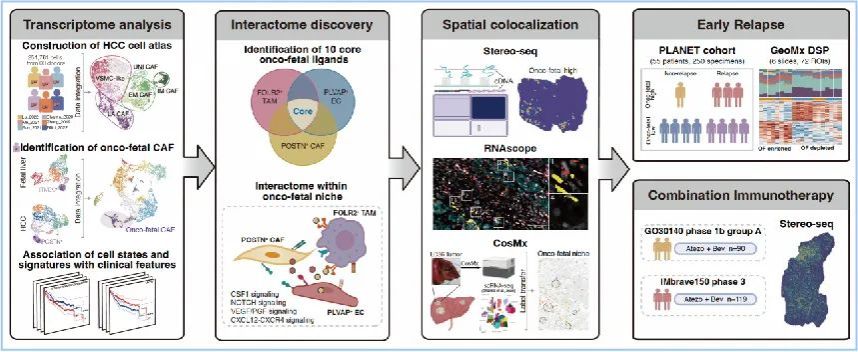
图1 研究流程图
为了对HCC的肿瘤微环境有一个全面的认知,研究人员首先整合了6个已发表数据集中251,761个单细胞的转录组测序数据,构建了一个全面的HCC单细胞图谱,并重点分析了其中CAF细胞的多样性,将其划分为5个不同的功能类群。之后,通过对比肿瘤和胎肝中成纤维细胞的相似性,发现与细胞外基质形成相关的POSTN+ CAF是肿瘤和胎肝共有的一群成纤维细胞,且该细胞类群上调IFNβ信号响应、细胞外基质建成、血管发育、细胞迁移调控等信号通路,表明其有助于塑造肿瘤微环境的免疫抑制状态(图2)。
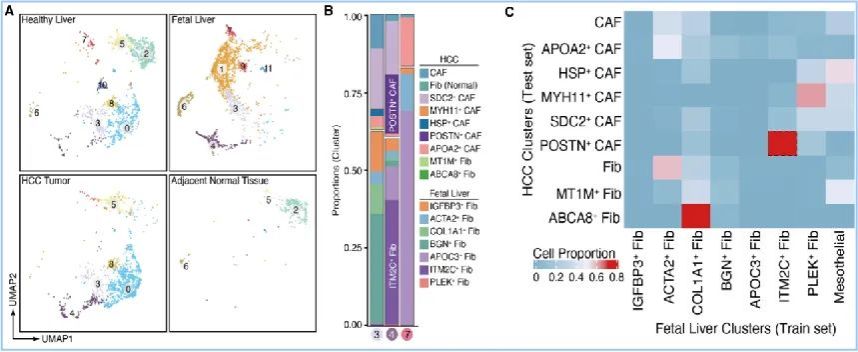
图2 肿瘤中的POSTN+ CAF具有“癌-胚”特征
研究人员使用CellChat等多种算法构建了HCC肿瘤微环境的细胞间相互作用网络,发现POSTN+ CAF、FOLR2+ TAM和PLVAP+ EC这三群癌胚细胞间具有紧密的细胞通讯联系,并且POSTN+ CAF是塑造“癌-胚”重编程环境的关键通讯枢纽。具体来说,POSTN+ CAF可以通过分泌CXCL12、CXCL16和IL34等多种分子,作用于其它的“癌-胚”细胞类群,调控其发育和招募过程。进一步,研究团队使用了包括Stereo-seq、RNAscope及CosMx在内的多种空间测序和成像手段,证明了这三群“癌-胚”细胞间的空间共定位关系和HCC肿瘤内“癌-胚”巢(onco-fetal niche)的存在(图3),表明“癌-胚”重编程过程是一个有着空间组织性的系统。
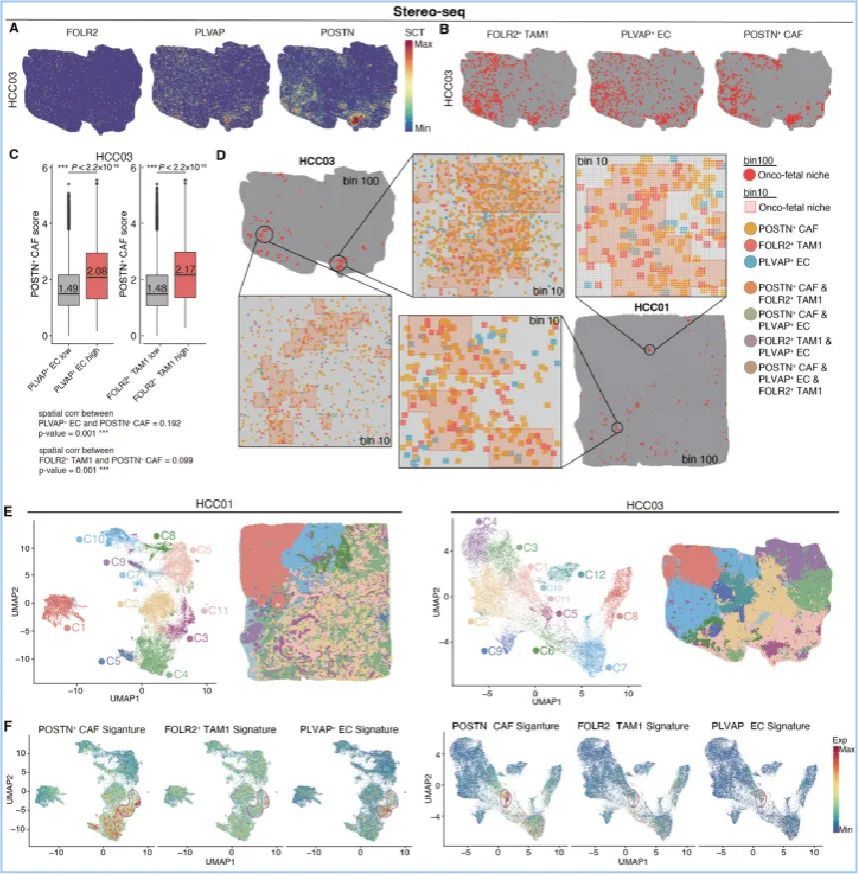
图3 Stereo-seq空间转录组证明“癌-胚”细胞群的空间共定位
肝细胞癌仍是目前最具侵袭性的肿瘤之一,在治疗后2年内约60%的患者存在术后复发的情况。考虑到“癌-胚”重编程代表胚胎早期发育过程,研究团队推测该过程很可能在肿瘤复发中起到关键作用。基于此设想,团队通过对三种“癌-胚”细胞群相对比例的加和定义了“癌-胚”得分(Onco-fetal score),并发现高“癌-胚”得分(OFhi)的患者发生术后复发的比例要显著高于低“癌-胚”得分的患者(OFlow)。同时,研究团队发现HCC复发患者中存在着两个不同的亚型,其中一个亚型与OFhi相关且具有上皮间质转化特征,另一个亚型则与OFlow相关且具有较强的代谢特征。最后,研究团队探究了“癌-胚”重编程过程与患者对于联合免疫治疗响应情况之间的关系,发现“癌-胚”重编程可能通过与Treg细胞的相互作用来影响HCC患者对anti-PD-L1+anti-VEGFA联合免疫治疗的响应性。
综上,本项研究鉴定出了一群参与HCC“癌-胚”重编程过程的重要细胞类群POSTN+ CAF,并通过空间转录组等技术证明了三群“癌-胚”细胞的空间共定位关系;揭示了 “癌-胚”重编程过程对HCC患者术后复发及治疗耐药的影响,为HCC的分层诊疗及开发新的免疫治疗策略提供了重要的分子靶点(图4)。
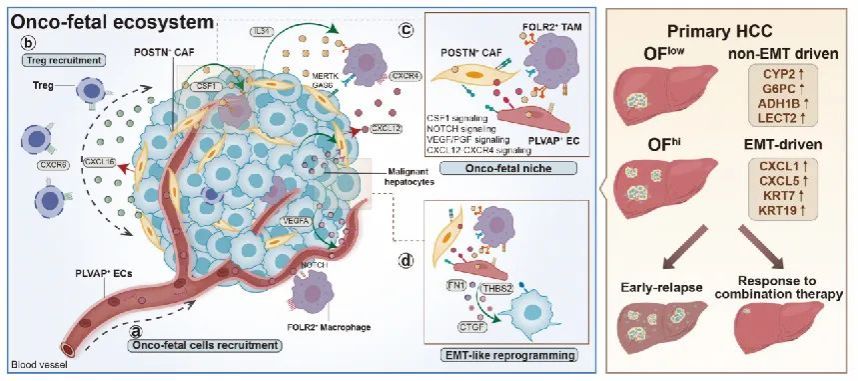
图4 文章结果总结
上海市免疫学研究所Florent Ginhoux教授,澳大利亚科廷大学Ankur Sharma教授及新加坡国家癌症中心Pierce Chow教授为本文的共同通讯作者,上海市免疫学研究所博士后李子逸为本文的第一作者。欧洲杯竞猜平台附属仁济医院夏强教授、冯浩教授团队及深圳华大生命科学研究院刘龙奇团队为本研究提供了大力支持。
「参考文献」
1.Sharma, A., et al. (2020). "Onco-fetal Reprogramming of Endothelial Cells Drives Immunosuppressive Macrophages in Hepatocellular Carcinoma." Cell 183(2): 377-394 e321.
 沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@sjtu.edu.cn
沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@sjtu.edu.cn