二十号,五月二十号,二零二零年五月二十号下午五点之前的一分钟我和研究者在一起,因为他的一句话,我会记住这一分钟。
“在这个干细胞I期临床研究项目里,我打算把受试者随机分配到三个不同的用药剂量组别中。”
那天天气明明很闷但是云却厚得落不下一滴雨,可在那一刻,我分明听到了雷炸开的声音,振聋发聩。
“不,你不可以。”

图片来源:giphy-seinfeld tv series
I期临床研究重点关注什么?
“我不明白,为什么不可以这么做呢?”
因为在I期临床研究中,我关注的是,你的药/技术/干预手段首次用于健康人群身上是不是安全(安全性评价),是不是随着剂量增加而出现不同程度的不良反应(剂量爬坡、最大耐受剂量、剂量限制毒性),以及药物在体内的分布去留(药代动力学)。
所有这些,我最在意的,是安全。
所以,I期临床研究试验很少将受试者进行随机分组,通常都是根据干预的强度,从低到高,对受试者进行不同程度的干预。只有在每一次干预剂量后,由研究者等相关个人或机构进行评估,确定对受试者安全后,才会开始下一递增剂量的研究。这不仅是出于安全性的考量,也是从伦理角度,科学、规范、充分保护受试者权益。
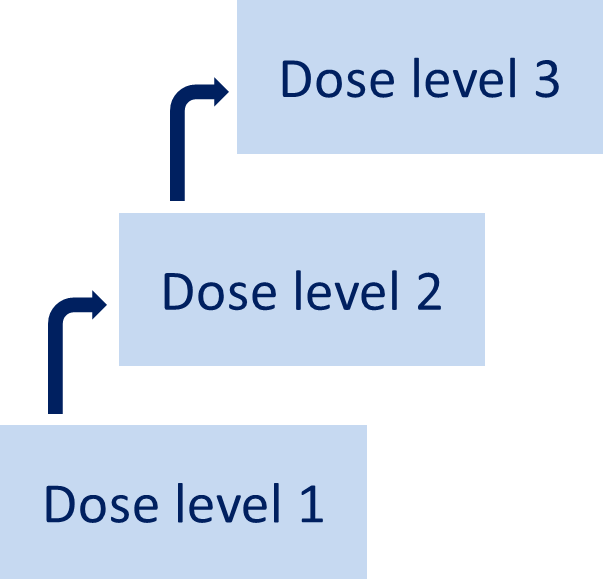
难道没有例外吗?
“可是为什么人家就可以这么做呢?”
他的声音里暗含着一丝焦躁,并且拿出了一沓打印好的文献,原来是陈薇院士发表在柳叶刀《The LANCET》上的一篇关于新冠疫苗I期临床研究的论文“Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial”。
 图片来源:The Lancet
图片来源:The Lancet
初看研究设计,似乎确实是将受试者平行分配到了3个不同剂量组别中。
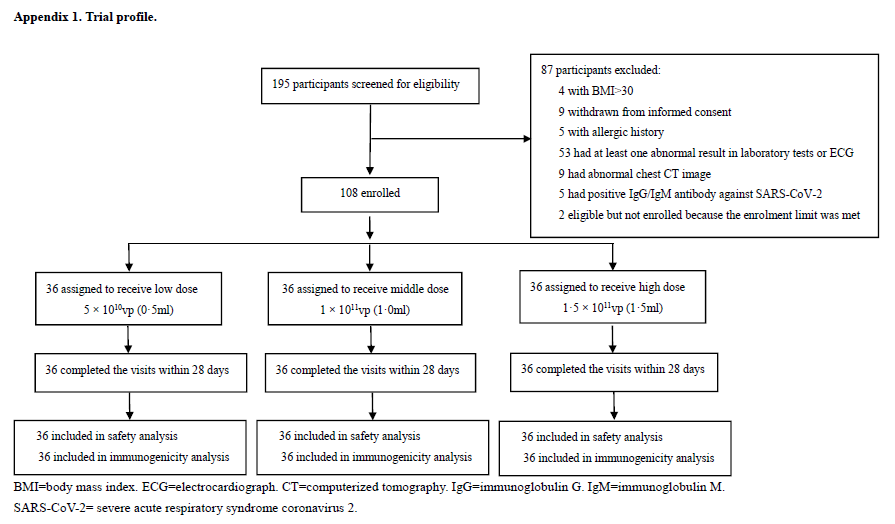
图片来源:Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-esclation, open-label, non-randomised, first-in-human trial supplementary appendix
同样是I期临床研究,难道因为是院士就可以这么做吗?还是因为在疫情的特殊背景下,这样的设计能够得到伦理委员会的认可,大开绿灯?
显然不是,在I期临床研究中,最好的通行证永远是安全性。
细读陈薇院士的这篇最新论文就能发现,其也是一项剂量递增,单中心,开放标签,非随机的I期试验。递增剂量组只有在上一组受试者经历了3天安全性观察评估确认安全以后才可以进行干预,并且一旦出现任何需要暂停剂量爬坡的指征,就会暂停递增剂量组的入组和干预。

“你看,院士也不例外,唯一的例外,只有安全。”
事实上,确实有I期临床试验以随机平行对照的方式进行。在中国临床试验注册中心官网上搜索可见,一项“硫酸益母草碱片在健康成年志愿者中单次给药的随机、双盲、耐受性、安全性和药代动力学特征临床试验”的注册信息中显示其研究设计就是随机平行对照。所有这些研究都有一个共同的标准,就是在确保受试者的安全的前提下进行设计的。
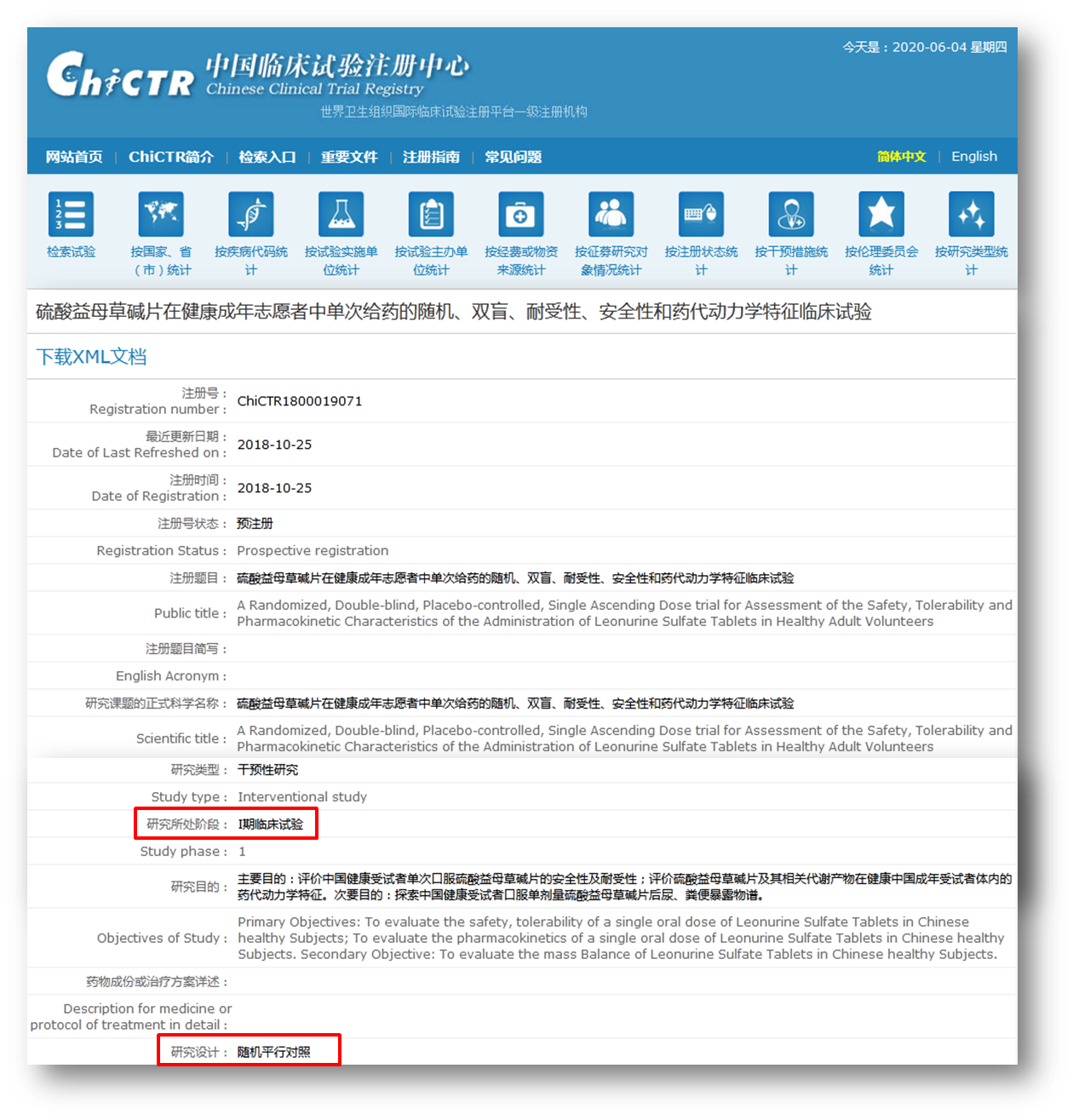
图片来源:中国临床试验注册中心
涉及到干细胞更要谨慎!
“干细胞I期临床研究更要谨慎,不能闷声不响只想搞个大研究。”
干细胞因其增殖和分化特性,可作为“种子”细胞参与细胞替代和组织再生,近二十年来一直是生命科学研究领域的前沿和热点,但作为一种新兴医疗技术,干细胞应用于疾病治疗也存在着异常分化、治瘤性、免疫原性等多种风险。鉴于此,无论如何都很难认可在干细胞I期临床研究中参考这样的平行入组方案。毕竟干细胞的安全性评估要比一般的药物I期研究更加困难,存在很多未知因素,因此需要更加慎重。临床试验是为了评估一项诊疗技术的安全性,有效性的研究,受试者或患者的安全性永远是放在第一位的。

“改方案吧,还是按照剂量递增,单中心,开放标签,非随机的I期试验进行设计吧。”
“行,听你的吧。”
“听科学的,别踩雷。”

图片来源:giphy-seinfeld tv series

