11月7日,Cancer Cell期刊在线发表了题为“Targeting the immune privilege of tumor-initiating cells to enhance cancer immunotherapy”的研究论文,该论文由欧洲杯竞猜平台附属仁济医院-上海市肿瘤研究所覃文新/王存团队,复旦大学附属中山医院高强教授团队,欧洲杯竞猜平台公共卫生学院、欧洲杯竞猜平台单细胞组学与疾病研究中心助理研究员郑铨以及德国癌症研究中心孙崇教授合作完成。该研究结合类器官与单细胞多组学技术,全面探讨了多种肿瘤干细胞标志物分子,发现高表达CD49f的肝癌细胞通过CXCL2-CXCR2招募中性粒细胞,形成独特的免疫抑制微环境。这些中性粒细胞通过分泌CCL4进一步维持肿瘤起始细胞的性征,并赋予它们“免疫特权”,使其能够通过表达CD155来逃避CD8+ T细胞的免疫攻击。研究还发现,同时针对PD-1和CD155的治疗策略不仅能有效清除CD49fhigh的肝癌起始细胞,还能破坏它们所依赖的免疫抑制微环境,显著提升免疫疗法的效果。

肿瘤起始细胞是一类具有自我更新能力并能推动肿瘤发展、维持和复发的细胞群体,它们在肿瘤的异质性、侵袭性和耐药性中扮演着关键角色。在肝癌领域,常用细胞表面蛋白如CD24、CD44、CD90、CD133和EPCAM等来识别潜在的肿瘤起始细胞。面对众多潜在的候选分子,如何区分和确定这些标记分子在肝癌精准治疗中的作用和重要性成为一个挑战。CITE-seq技术能够在单细胞水平上同时分析转录组和细胞表面蛋白的表达,为研究者提供了研究多种表面标记分子的生物学特性及其相互作用的机会。在这项研究中,研究者对来自LICOB生物库的肝癌类器官进行了CITE-seq测序,全面分析了14个经典的肿瘤起始细胞标记分子和5个与免疫抑制相关的表面标记分子。结果显示,不同标记分子在样本中的表达存在显著的异质性,并且它们在标示肿瘤起始细胞方面的能力也存在显著差异。在这些标记分子中,CD49f以其最低的表达异质性和功能异质性脱颖而出,显示出高效的肿瘤起始细胞标示能力。CD49f由ITGA6基因编码,是一种细胞表面整合素蛋白,已证实与细胞干性相关,但在肝癌起始细胞的研究中,其应用潜力尚未被充分挖掘。
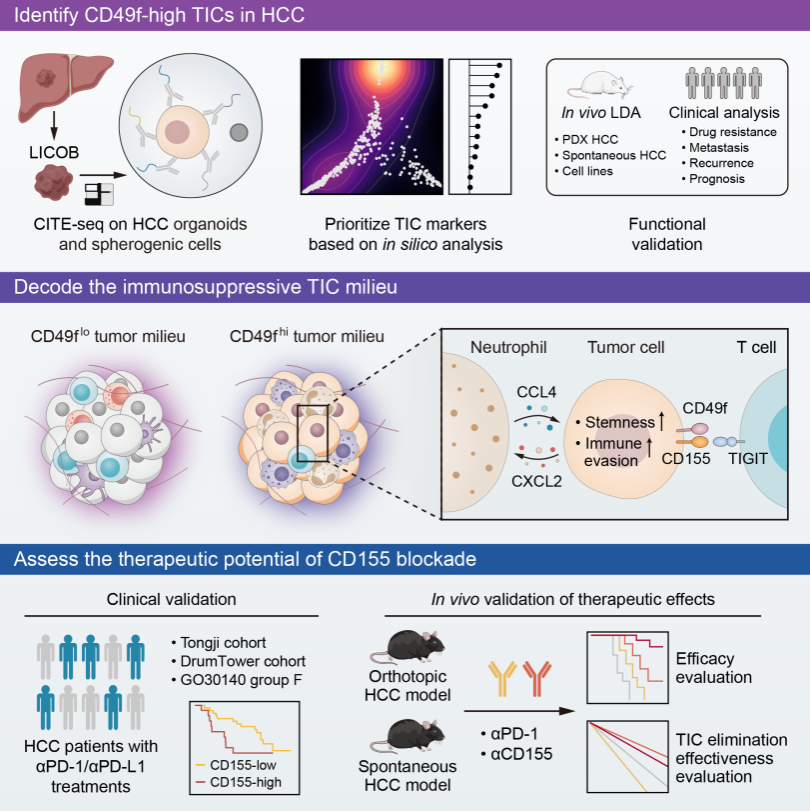
研究工作模式图
研究者在探究CD49fhigh肝癌起始细胞的生物学功能时,发现这些细胞能分泌大量细胞因子吸引髓系细胞的浸润。进一步分析揭示了CD49fhigh肝癌起始细胞与中性粒细胞之间存在密切的相互作用,由SOX9基因驱动CXCL2的分泌进而招募中性粒细胞,反过来这些中性粒细胞则通过CCL4-STAT3信号通路维持并促进肿瘤起始细胞的特性。CCL4-STAT3信号通路的激活还会增强PVR基因(编码膜蛋白CD155)的表达。此外,CD49f在细胞膜上与CD155紧密结合,进一步在蛋白水平上稳定CD155。在这两种机制的共同作用下,CD49fhigh肝癌起始细胞通过高表达CD155获得“免疫特权”,从而逃避CD8+ T细胞的免疫攻击。然而这种“免疫特权”也成为这类肝癌起始细胞的“免疫弱点”。研究者提出,联合靶向PD-1和CD155的治疗策略不仅能清除这些肿瘤起始细胞,还能减少肿瘤微环境中免疫抑制性中性粒细胞的浸润。
上海市肿瘤研究所王存研究员,复旦大学附属中山医院高强教授,上海市肿瘤研究所覃文新研究员,欧洲杯竞猜平台公共卫生学院、欧洲杯竞猜平台单细胞组学与疾病研究中心欧洲杯竞猜平台单细胞组学与疾病研究中心助理研究员郑铨,德国癌症研究中心教授孙崇为本文通讯作者。本文的第一作者为杨晨博士、耿海刚博士、杨旭鹏博士、纪姝伊副研究员、刘志承博士和冯浩博士。本项目得到国家自然科学基金委和上海市科学技术委员会相关计划资助。

